|
Глава
4. Общие представления об иммунном ответе
Michael O'Connell, M.D.
Глава
5. Воспаление. Общие положения
Michael O'Connell, M.D.
Глава
6. Иммуногенетика и ревматические заболевания
Nicholas}. Battafarano,
M.D.
Глава
7. Толерантность и аутоиммунитет
NicholasJ. Battafarano,
M.D.
//. Научные основы понимания
ревматических болезней
Источник всех знаний лежит в желании
знать причины.
Вильям Хазлитт, 1829
Развитие науки серьезно замедляется
изучением того,
что не требует изучения и непознаваемо...
Иоганн Вольфганг фон Гете, 1825
ГЛАВА 4. ОБЩИЕ ПРЕДСТАВЛЕНИЯ
ОБ ИММУННОМ ОТВЕТЕ
Michael O'Connell, M.D.
1. Что представляют собой
два вида иммунитета, участвующих в защите организма?
Виды иммунитета
|
|
ВРОЖДЕННЫЙ
|
ПРИОБРЕТЕННЫЙ
|
|
|
Физические
барьеры Факторы крови Клетки Медиаторы клеточного воспаления
|
Кожа, слизистые
оболочки Комплемент Макрофаги, нейтрофилы Монокины
|
Иммунные
системы слизистой оболочки Антитела Лимфоциты Лимфокины
|
|
2. Опишите активный и пассивный
приобретенный иммунитет. Активный иммунитет назван так потому, что организм
человека борется с антигеном. Самым лучшим примером активного иммунитета
является иммунизация, при которой вакцина, содержащая экзоантиген, вводится
в неиммунизированный организм, что приводит к выработке в нем специфических
антител и лимфоцитов "памяти".
Пассивный иммунитет обусловлен
передачей растворимых готовых факторов (антител или клеток) от иммунизированного
индивидуума к неиммунизированному, после чего реципиент уже не нуждается
в предварительном контакте с антигеном. Примером формирования пассивного
иммунитета является парентеральное введение сывороточного иммуноглобулина
для профилактики редких инфекций.
3. Чем отличаются два главных
типа лимфоцитов?
• Т-лимфоциты, или Т-клетки,
являются тимусзависимыми и имеют Т-клеточ-ные рецепторы на поверхности.
Эти клетки могут быть отделены от других лимфоцитов с помощью моноклональных
антител, которые распознают CD3 (компонент Т-клеточного рецептора). Постоянно
циркулирующие в крови лимфоциты в основном представлены Т-клетками.
• В-лимфоциты, или
В-клетки, образующиеся в костном мозге, секретирующие антитела. Эти клетки
имеют на поверхности иммуноглобулины.
4. Специфический иммунный
ответ может быть различен в зависимости от первичного задействования Т-
или В-клеток. Назовите эти виды иммунитета.
1. Гуморальный иммунитет
ответственен
за иммунный ответ с участием антител, продуцируемых В-клетками и плазматическими
клетками (особый вид В-клеток).
2. Клеточный иммунитет
является
промежуточным, осуществляется посредством Т-клеток, секретирующих цитокины,
и сигнальных эффекторных клеток, необходимых для полного клеточно-гуморального
иммунного ответа.
5. Как антитела участвуют
в воспалении и иммунном ответе?
Существуют три основных способа,
посредством которых антитела проявляют им-мунологическую активность:
1. Антитела могут покрывать
и нейтрализовывать чужеродные микроорганизмы, не позволяя им размножаться
в макроорганизме.
2. Антитела двух классов
(IgM и IgG) активируют систему комплемента в результате хемотаксиса клеток,
повышения сосудистой проницаемости и прицельного цитолиза.
3. Антитела покрывают инородные
частицы (опсонизация), повышая эффективность фагоцитоза нейтрофилами и
макрофагами, имеющими на своей поверхности иммуноглобулиновые рецепторы.
6. Против каких видов
микроорганизмов гуморальный (опосредованный через антитела) иммунитет является
самым важным в защите макроорганизма?
Против бактерий, имеющих
полисахаридную капсулу. Пациенты с тяжелым дефицитом антител (гипогаммаглобулинемия)
страдают заболеваниями придаточных пазух носа и пневмониями, вызванными
микроорганизмами, имеющими капсулу.
7. Назовите четыре основных
класса антител. Каковы их специфические роли в гуморальном иммунитете?
Для запоминания удобен мнемонический
ключ GAME:
G — IgG, его концентрация
в сыворотке крови самая высокая, отлично проникает в ткани и через плаценту.
Фиксирует комплемент.
А — IgA, самое важное антитело
в системе защиты слизистых оболочек макроорганизма (входные ворота инфекции).
Синтезируется местно, часто присутствует в модифицированных формах в секретах
(слезы и слюна) (секреторный IgA). Секреторный IgA более устойчив к разрушению
ферментами. М — IgM. Это первый класс иммуноглобулинов, нарабатываемых
при первичной реакции на внедрение антигена. Прочно фиксирует комплемент,
очень важен в защите макроорганизма от антигенов, образующихся в крови.
Е — IgE связывается с поверхностью тучных клеток и базофилов, после чего
происходит высвобождение гранул (в основном с гистамином). Имеет важное
значение при аллергических заболеваниях и защите организма от паразитов.
Примечание: антитело
(иммуноглобулин) так же называется у-глобулином, так как содержится преимущественно
в уфракции, что определяется при электрофорезе белков сыворотки крови в
геле.
8. Какие существуют типы
Т-клеток? Чем они отличаются?
• Т-клетки подразделяются
на следующие подтипы: хелперы/индьюсеры, суп-рессоры и цитотоксические.
• Большинство хелперов/индьюсеров
экспрессируют на поверхность Т-клетки маркер CD4.
• Цитотоксические Т-клетки
экспрессируют на поверхности маркер CD8.
• Т-супрессоры также экспрессируют
маркер CD8 на своей поверхности; их существование как отдельного подтипа
Т-клеток оспаривается.
9. Против каких инфекционных
агентов самым важным в защите макроорганизма является клеточный иммунитет
(Т-клеточноопосредованный)?
Против вирусов, паразитов,
грибов и микобактерий. Пациенты с ВИЧ-инфекцией имеют тяжелое расстройство
Т-клеточного звена иммунитета и страдают рецидивирующими инфекциями, вызванными
перечисленными возбудителями.
10. Что такое клетки "природные
киллеры", как они идентифицируются?
Они получили такое название,
поскольку являются мощными цитотоксическими клетками, и их мишени не ограничены
системой главного комплекса гистосовмес-тимости (т. е. они не являются
антигенспецифичными). При световой микроскопии они имеют вид больших лимфоцитов
с многочисленными цитоплазматически-ми гранулами; иногда их называют большими
гранулярными лимфоцитами. Данные клетки экспрессируют поверхностные CD
16- и СО56-маркеры и не экспрессируют CD4 и CD8.
11. Назовите, согласно
классификации Геля (Gel) и Кумбса (Coombs), четыре типа иммунного ответа.
Тип I — IgE-гиперчувствительность
немедленного типа (аллергический ринит или сенная лихорадка).
Тип II — повреждение
тканей антителами (аутоиммунная гемолитическая анемия).
Тип III — образование
иммунных комплексов (антиген-антитело) (сывороточная болезнь, кожная реакция
Артюса).
Тип IV — гиперчувствительность
замедленного типа (иммунный ответ на микобак-териальные антигены, положительный
кожный тест с РРД — туберкулиновая проба).
12. Что такое молекулы
главного комплекса гистосовместимости и какие клетки он выявляет?
Главный комплекс гистосовместимости
(ГКГ) представляет собой группу генов, локализованных в 6-й паре хромосом.
Продукты гена комплекса гистосовместимости подразделяются на две категории
— молекулы класса I и класса II.
• Молекулы комплекса гистосовместимости
класса I имеются на поверхности всех клеток, содержащих ядро.
• Молекулы комплекса гистосовместимости
класса II находятся, главным образом, в специализированных клетках, называемых
антигенпрезентирующими.
13. Как Т-клетки узнают
антиген, а затем инициируют специфический иммунный ответ?
1. В отличие от макрофагов,
нейтрофилов и В-клеток, Т-клетки не способны распознавать свободно циркулирующий
(растворимый) антиген.
2. Т-клетки могут "видеть"
антиген только через поверхностный Т-клеточный рецептор, который связывается
с антигеном, прикрепленным к молекуле комплекса гистосовместимости на поверхности
клетки.
3. Т-клетки "узнают" только
часть антигена значительных размеров, поскольку антигенсвязывающий участок
в молекуле комплекса гистосовместимости приспосабливает для этого небольшие
пептиды. Перед тем как войти в бороздку молекулы ГКГ значительные по размерам
белковые антигены подвергаются "процессингу" (подгонке).
14. Какие клетки относятся
к антигенпрезентирующим? Где они расположены?
|
|
|
|
|
ТИП КЛЕТОК
|
ЛОКАЛИЗАЦИЯ
|
|
|
Макрофаги
|
|
|
|
Гистиоциты
|
Соединительная
ткань
|
|
|
Моноциты
|
Кровь
|
|
|
Альвеолярные
макрофаги
|
Легкие
|
|
|
Купферовские
клетки
|
Печень
|
|
|
Микроглия
|
ЦНС
|
|
|
Остеокласты
|
Кости
|
|
|
Дендритные
клетки
|
Кожа, лимфатические
узлы
|
|
|
Клетки Лангерганса
|
Кожа
|
|
|
В-лимфоциты
|
Лимфатические
узлы
|
|
|
|
|
|
15. Какому типу Т-клеток
"представляют" антигены антигенпрезентирующие клетки?
• Антигенпрезентирующие клетки
(АПК) экспрессируют молекулы поверхностного комплекса гистосовместимости
класса II.
• Молекулы класса II преимущественно
связываются с рецепторами Т-клеток, сочетающимися с CD4 поверхностными
молекулами.
• Таким образом АПК представляют
антиген по CD4+ Т-клеткам (хелперам/ индьюсерам).
16. Какой тип Т-клеток
узнает антиген, презентированный молекулами ГКГ класса I?
Молекулы ГКГ класса I предпочтительно
связываются с Т-клеточными рецепторами, ассоциированными с поверхностными
молекулами CD8. Затем антиген проникает в бороздку молекулы класса I и
взаимодействует с CD8+ Т-клеток (цитотокси-ческие/супрессоры). Молекулы
ГКГ класса I присутствуют на поверхности всех клеток, имеющих ядро, позволяя
им обеспечивать взаимодействие их внутренних антигенов с цитотоксическими
Т-клетками. Наличие такого механизма чрезвычайно важно для защиты макроорганизма
от внутриклеточных возбудителей, например вирусов.
17. Как происходит активация
Т-клеток?
Активация Т-клеток требует
выполнения двух условий:
• взаимодействие Т-клеточного
рецептора с комплексом антиген-молекула ГКГ;
• непосредственный контакт
("соприкосновение") между стимулирующими молекулами клеточной поверхности
на АПК-клетках и Т-клетками. При выполнении этих условий Т-клетки активируются,
что приводит к выработке цитоплазматических и ядерных факторов, которые
активируют ген, и, как следствие, синтезируется новая ДНК.
18. Что происходит, если
Т-клеточный рецептор связался с комплексом антиген/ ГКГ, но второе условие
не выполняется?
Т-клетки становятся толерантными
к антигену (на введение антигена иммунная система не отвечает), или клетки
гибнут путем апоптоза.
19. Какова роль нейтрофилов
в иммунном ответе?
Нейтрофилы очень важны для
процессов фагоцитоза и биологической утилизации инородных частиц в зоне
воспаления и во входных воротах инфекции. Нейтрофилы убивают и разрушают
микроорганизмы, выделяя ферменты и бактерицидные соединения из внутрицитоплазматических
гранул, а также за счет синтеза токсических кислородных радикалов и гипохлорной
кислоты. Дефицит лейкоцитов клинически проявляется рецидивирующими гнойными
инфекциями кожи и мягких тканей, сепсисом (наблюдается у больных со злокачественными
опухолями, получающими химиотерапию).
20. Какова роль эозинофилов
в иммунном ответе?
Эозинофилы принимают активное
участие в формировании иммунитета против паразитов, особенно гельминтов.
Эозинофилы — специализированная группа лейкоцитов. Они имеют гранулы, содержащие
многочисленные токсичные вещества, в том числе и главный основной белок,
пероксидазу и катионный белок. Все перечисленные соединения токсичны для
гельминтов.
21. Какова роль комплемента
в иммунном ответе?
Комплемент обладает иммунологической
активностью как сам по себе, так и в результате активации цепи процессов,
приводящих к формированию полимера, состоящего из С5, С6, С7, С8 и С9 (комплекс,
атакующий мембраны клеток), который вызывает лизис клеточных мембран (см.
рисунок). Ранее считалось, что компоненты
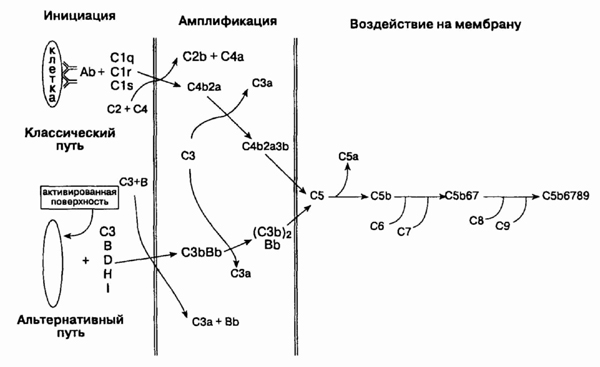
Классический и альтернативный пути
каскада комплемента
комплемента (особенно его
СЗ-продукты) функционируют в качестве опсонинов и участвуют в фагоцитозе
бактериальных частиц нейтрофилами и макрофагами. Продукты расщепления комплемента
определенного типа (СЗа и С5а) обладают хемо-таксическими свойствами для
фагоцитирующих нейтрофилов и также действуют как "анафилатоксины", которые
напрямую стимулируют тучные клетки и базофилы. Эти клетки выделяют гистамин,
что обусловливает повышение сосудистой проницаемости. Дефицит ранних компонентов
комплемента приводит к увеличению частоты возникновения гнойных инфекций
(дефицит СЗ) и числа аутоиммунных заболеваний (дефицит С1, С2 и С4), возможно,
из-за ухудшения клиренса из крови иммунных комплексов. Мембраноатакующие
комплексы являются особенно важными при защите макроорганизма от возбудителей
рода Neisseria. Дефицит любого компонента комплемента может сопровождаться
рецидивирующими инфекциями, вызываемыми этими возбудителями.
22. Опишите клеточные
взаимодействия и виды цитокинов, вовлеченных в иммунный ответ.
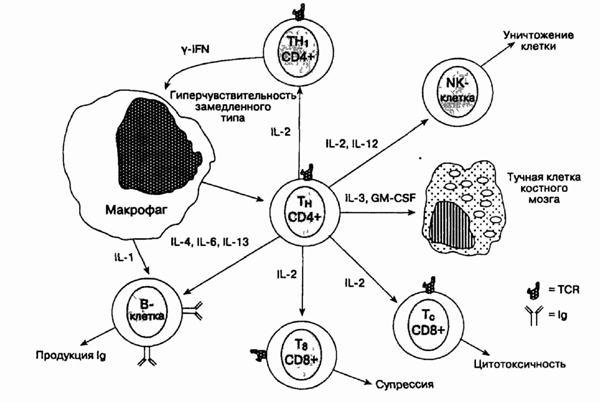
Схема клеточного иммунитета, показывающая
центральную роль CD4+ Т-хелперов. IL — интерлей-кин; TCR — Т-клеточный
рецептор; Ig — иммуноглобулин; NK — природный киллер; IFN — интерфе-рон;
GM-CSF — гранулоцитарный макрофагальный колониестимулирующий фактор; ТН
— Т-хелпер
Избранная литература
Abbas А. К., Lichtman A.
H., Pober J. S. Cellular and Molecular Immunology, 2nd ed. Philadelphia,
W. B. Saunders, 1994.
Goodman J. W. The immune
response. In: Stites D. P., Terr A. I., Parslow T. G. (eds) Basic and Clinical
Immunology, 8th ed. Norwalk, CT, Appleton & Lange, 1994, 40-49
Johnston R. В. The complement
system in host defense and inflammation: The cutting edges of a double-edged
sword. Pediatr. Infect. Dis.J., 12: 933-941, 1993.
Keller R. The macrophage
response to infectious agents: Mechanisms of macrophage activation and
tumor cell killing. Res. Immunol., 144: 271-273,1993.
Roitt I., Brostoff J., Male
D. Immunology, 3rd ed. St. Louis, Mosby, 1993.
ГЛАВА 5. ВОСПАЛЕНИЕ.
ОБЩИЕ ПОЛОЖЕНИЯ
Michael O'Connell, M.D.
1. Назовите четыре основных
признака воспаления.
Боль, отек, гипертермия и
эритема.
2. Какие механизмы ответственны
за появление симптомов воспаления?
Местное расширение артериол
вызывает гиперемию (эритему) и гипертермию. Повышение проницаемости посткапиллярных
венул позволяет жидкости из сосудов просачиваться в окружающие ткани, что
приводит к отеку. Боль — результат воздействия на местные нервные окончания
многочисленных медиаторов воспаления и соединений, образующихся в воспаленных
клетках.
3. Для макроорганизма
воспалительные реакции могут быть вредными или полезными. Приведите примеры,
иллюстрирующие это. Вредные
• Аллергические заболевания,
в которых IgE-опосредованные воспалительные реакции (тип 1) обусловлены
контактом с аллергеном и проявляются выраженными симптомами (ринитом, анафилаксией),
несмотря на то, что инициирующий агент часто не угрожает жизни человека
(например при поллинозе).
• Аутоиммунные заболевания,
в которых иммуннообусловленное воспаление "ошибочно" возникает в ткани
макроорганизма, приводя к ее повреждению и последующему разрушению. Полезные
• При инфекциях, вызванных
чужеродными микроорганизмами, повышенная сосудистая проницаемость позволяет
клеткам иммунной защиты (нейтрофи-лам, лимфоцитам) в большом количестве
покидать кровоток и проникать в те ткани, где внедрились возбудители.
• При инфекции усиливается
локальный кровоток, что усиливает доставку кислорода к воспаленным тканям.
4. Какие типы воспалительных
клеток участвуют в воспалительных реакциях?
Нейтрофилы, макрофаги и лимфоциты.
Нейтрофилы преобладают в острой воспалительной реакции, тогда как лимфоциты
— основные участники хронического воспалительного процесса. Другие клетки
важны для реализации специальных типов воспалительных ответов. Тучные клетки
и базофилы участвуют в аллергических ре-
акциях (IgE-гиперчувствительность).
Эозинофилы имеют принципиальное значение для защиты от паразитарных инфекций.
5. Какие свойства нейтрофилов
позволяют им участвовать в остром воспалительном ответе при внедрении патогенного
агента?
Нейтрофилы привлекаются несколькими
типами хемотаксических раздражителей к месту повреждения тканей вне зависимости
от его природы. Это свойство обеспечивает быстрый клеточный ответ при разнообразных
видах повреждения, включая инфекции, травмы, инородные тела и ожоги. А
поскольку в крови постоянно циркулирует большое количество нейтрофилов
и при повреждении происходит быстрая мобилизация значительного числа клеток,
то нейтрофилы и оказываются клетками "первой линии защиты".
6. Как нейтрофилы нейтрализуют
инородные субстанции, попавшие в организм человека?
Нейтрофилы являются активно
фагоцитирующими клетками, то есть, способны к поглощению инородных частиц.
Мембраны этих клеток имеют рецепторы против антител и фрагментов комплемента,
что значительно усиливает фагоцитоз опсони-зированных частиц. После поглощения
инородных частиц из гранул нейтрофилов выделяются ферменты и вещества,
убивающие микроорганизмы. Это приводит к нейтрализации/разрушению инородных
частиц и местному изменению тканей — первому этапу в заживлении повреждения.
7. Макрофаги также являются
фагоцитирующими клетками. В чем их отличие от нейтрофилов при воспалительной
реакции?
Макрофагам присущи три ключевых
особенности, отличающие их от нейтрофилов:
1. Они экспрессируют молекулы
II класса ГКГ на своей поверхности и функционируют как антигенпрезентирующие
клетки.
2. Они секретируют различные
провоспалительные и стимулирующие воспаление цитокины, включая фактор некроза
опухоли, интерлейкин-1 (ИЛ-6 и ИЛ-8), которые участвуют в так называемой
острофазовой реакции.
3. Макрофаги реагируют на
определенные цитокины (выделенный из Т-клеток у-интерферон), которые их
активируют, значительно повышают мощность фагоцитоза и способствуют агрегации
в гранулемы и многоядерные гигантские клетки.
8. Какое участие принимают
лимфоциты в хронических воспалительных реакциях?
Т-лимфоциты являются контролерами
специфического иммунного ответа. После антигенной стимуляции через антигенпрезентирующие
клетки, Т-клетки секретируют цитокины, которые (1) определенным образом
направляют и активируют эффек-торные клетки (макрофаги) и/или (2) передают
информацию В-клеткам о необходимости продукции антигенспецифических антител.
Эти процессы существуют длительно, поскольку определенные Т- и В-клетки
дифференцируются в клетки памяти с очень большим сроком жизни.
9. Назовите основные классы
медиаторов воспаления.
|
|
|
|
|
Вазоактивные
медиаторы
Гистамин Продукты арахидоновой
кислоты Простагландины Лейкотриены
|
Хемотаксические
факторы
Продукты комплемента (СЗа,
С5а) Лейкотриен В4 Тромбоцитактивирующий фактор Цитокины (ИЛ-8)
|
|
|
|
|
|
|
|
|
|
|
Тромбоцитактивирующий
фактор Кинины Ферменты Триптаза Химаза
|
Провоспалительные
цитокины
ИЛ- 1, ИЛ-6 и ИЛ-8 Фактор
некроза опухоли у-Интерферон
|
|
|
|
|
|
10. Как гистамин поддерживает
воспаление?
Гистамин является заранее
синтезированным медиатором, который после активации тучных клеток и базофилов
быстро освобождается из гранул. Гистамин взаимодействует со специфическими
клеточными рецепторами (называемыми HI, H2 и НЗ), что сопровождается повышением
сосудистой проницаемости, секреции желез слизистых оболочек и сокращением
гладкой мускулатуры бронхов. Клинически эти процессы проявляются чиханием,
стридорозным дыханием, зудом и отеком. Антигиста-минные препараты блокируют
рецепторы и уменьшают выраженность или предотвращают развитие симптомов.
11. Как образуются простагландины
и лейкотриены?
В отличие от гистамина (который
синтезируется и депонируется) простагландины и лейкотриены требуют активного
синтеза. Они образуются из молекулы арахидоновой кислоты, которая освобождается
из фосфолипидов клеточной мембраны. Метаболизм арахидоновой кислоты может
идти по одному из двух ферментативных путей:
1. Циклооксигеназный путь,
приводящий к образованию простагландинов.
2. Липоксигеназный путь,
приводящий к образованию лейкотриенов.
12. Как простагландины
и лейкотриены участвуют в воспалении?
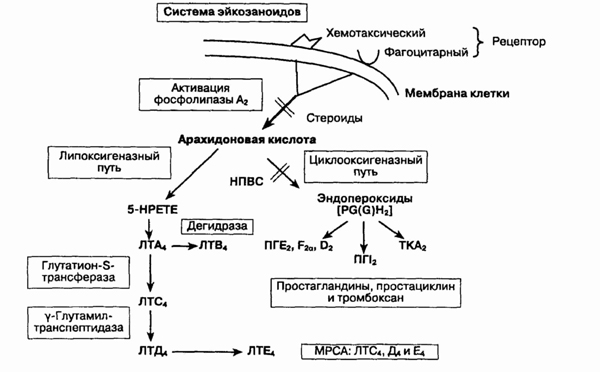
Образование эйкозаноидов
Простагландины (особенно
простагландин D2) вызывают местную вазодилатацию и повышают
сосудистую проницаемость. Лейкотриены (ЛТ) разделяют на два класса: ЛТС4,
ЛТО4 и ЛТЕ4 вызывают спазм гладкомышечной мускулатуры, бронхоспазм и повышение
секреции желез слизистых оболочек. Эти фракции ранее называли общим термином
— медленно реагирующая субстанция анафилаксии (МРСА). ЛТВ4 является мощным
хемотаксическим фактором для лейкоцитов.
13. Каков механизм противовоспалительного
действия аспирина и НПВС?
• Как аспирин, так и НПВС
блокируют активность циклооксигеназы, что приводит к уменьшению синтеза
простагландинов.
• Препараты, блокирующие
синтез лейкотриенов, пока находятся на стадии экспериментальной разработки.
14. Что такое острофазовая
реакция? Какие белки крови в ней участвуют?
Острофазовая реакция — сложный
каскад в основном синтезированных печенью белков, содержание которых увеличивается
при различных инфекциях или иммунном стимуле. Эта реакция проявляется многочисленными
метаболическими и клеточными изменениями, которые обеспечивают защиту и
поддержание гомеостаза макроорганизма.
Основные белки острой
фазы воспаления (острофазовые белки) включают альфа-1-антитрипсин,
СЗ, церулоплазмин, С-реактивный белок (СРВ), фибриноген, гаптоглобин и
сывороточный амилоид А.
15. Какие механизмы запускают
острофазовую реакцию (ОФР)?
Макрофаги и моноциты — основные
клетки инициации ОФР (возможно, Т-клетки также играют определенную роль).
Активированные антигеном или другим раздражителем макрофаги секретируют
ИЛ-1, ИЛ-6 и фактор некроза опухоли. ИЛ-6 — мощный гепатоцитстимулирующий
фактор, увеличивающий синтез белков в острой фазе воспаления. ИЛ-1 облегчает
действие ИЛ-6 на гепатоциты.
Избранная литература
Ballou S., Kushner I. C-reactive
protein and the acute phase response. Adv. Intern. Med., 37: 313-336,1992.
Dinarello C. A., Wolff S.
M. The role of mterleukin-1 in disease. N. Engl. J. Med., 328: 106-113,
1993.
Holtzman M. J. Arachidonic
acid metabolism. Am. Rev. Respir. Dis., 143: 188-203, 1991.
Johnson R. B. The complement
system in host defense and inflammation: The cutting edges of a double-edged
sword. Pediatr. Infect. Dis. J., 12:933-941,1993.
Keller R. The macrophage
response to infectious agents: Mechanisms of macrophage activation and
tumor cell killing. Res. Immunol., 144: 271-273,1993.
Sox H., Liang M. The erythrocyte
sedimentation rate — Guidelines for rational use. Ann. Intern. Med., 104:515-523,1986.
Terr A. I. Inflammation.
In: Stites D. P., Terr A. I., Parslow T. G. (eds). Basic and Clinical Immunology,
8th ed. Norwalk, CT, Appleton & Lange, 1994, 137-150.
ГЛАВА 6. ИММУНОГЕНЕТИКА
И РЕВМАТИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Nicholas J. Battafarano, M.D.
1. Какие три типа молекул,
относящиеся к иммунной системе, связывают специфические антигены?
Иммуноглобулины, Т-клеточные
рецепторы и молекулы ГКГ класса I и II.
Каждый из этих молекулярных
классов имеет свои связи с определенными ревматическими заболеваниями.
Наличие связи между конкретными аутоиммунными заболеваниями и экспрессией
специфических молекул комплекса гистосовместимо-сти позволяет разобраться
в патогенезе и прогнозировать вероятность возникновения заболевания.
2. Что такое главный комплекс
гистосовместимости и какова его функция?
ГКГ локализован в коротком
плече 6-й хромосомы в области, содержащей почти 4 млн пар оснований. Существуют
три области, кодирующие три различных класса белков,— комплекс гистосовместимости
класса I, II и III (см. рисунок).
Самый большой по протяженности
участок (почти 2 млн пар нуклеотидов) кодирует молекулы класса I. Более
короткий участок (около 1 млн пар нуклеотидов) кодирует молекулы класса
П. Функция молекул этих двух классов заключается в презентации антигенов
Т-клеткам. Оставшийся участок комплекса гистосовместимости между областями,
относящимися к классам I и II, кодирует различные белки, и не способные
выявлять антиген.
Однако многие белки класса
III участвуют в регуляции иммунного ответа, и некоторые из них связаны
с возникновением ревматических заболеваний, в том числе С2, С4 и фактор
В системы комплемента, факторы некроза опухоли (а и (3) и некото-
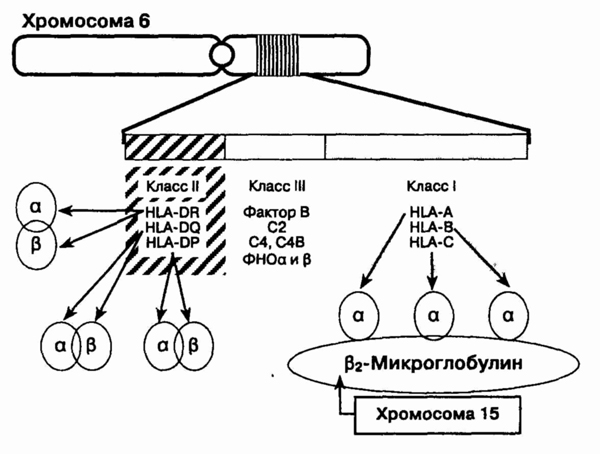
Главный комплекс гистосовместимости
рые белки теплового шока.
Молекулы класса I и класса II являются димерами. Комплекс гистосовместимости
кодирует а- и р-цепи молекул класса II, но только сх-цепи класса I. Р2-Микроглобулин,
р-цепь всех молекул класса II, кодируется относительно инвариантной аллелью
15-й хромосомы.
3. Существуют ли отличия
между комплексом гистосовместимости и человеческим лейкоцитарным антигеном
(HLA)?
В практических целях эти
термины взаимозаменяемы. И все же они различны. Термин "главный комплекс
гистосовместимости" преимущественно используется для обозначения генов,
локализованных в 6-й хромосоме. Этот комплекс кодирует HLA. Термин "человеческий
лейкоцитарный антиген" применяется для обозначения молекулярных продуктов
генов комплекса гистосовместимости, т. е. HLA-молекулы — белки клеточной
поверхности, кодируемые различными локусами комплекса гистосовместимости.
Эти белки являются антигенами, поскольку похожи на большинство белков клеточной
поверхности и могут быть распознаны Т-клеточными рецепторами и иммуноглобулинами.
Впервые они были описаны как человеческие лейкоцитарные антигены (HLA).
Однако известно, что они распределены значительно шире, чем только в лейкоцитах.
С точки зрения специальной терминологии, "комплекс гистосовместимости"
и "HLA" не идентичны.
4. Почему главный комплекс
гистосовместимости такой необычный по сравнению с остальной частью генома
человека?
Многообразие комплекса гистосовместимости
не соответствует остальной части генома. Существуют различные факторы,
обусловливающие это многообразие. Во-первых, ГКГ имеет много генетических
локусов, кодирующих молекулы одного класса. К тому же комплекс гистосовместимости
отличается полиморфизмом, нарушением равновесия в сцеплении генов и кодоминантным
характером наследования.
5. В чем суть полиморфизма?
Аллель — одна из альтернативных
форм гена, которая может быть наследована в специфическом локусе. Количество
альтернативных аллелей для большинства локусов генов класса I и II ГКГ
превышает частоту возникновения одиночной мутации. Кроме того, в отличие
от единичных остатков различных аллелей, которые характеризуют другие белки,
такие как иммуноглобулин, полиморфизм аллелей ГКГ проявляется различиями
во многих остатках. Поэтому вместо белка (продукта гена), отличающегося
от одной до трех аминокислот только в одном положении, молекулы ГКГ могут
различаться по своему аминокислотному составу более чем на 10 %. Эти отличия
наблюдаются в нескольких молекулах ГКГ, но большинство изменений характерно
для трех специфических участков, так называемых гипервариабельных участков
1, 2 и 3. Они ответственны только за определенные связи пептидных фрагментов.
Такой генетический полиморфизм не является происшествием. Наоборот, это,
вероятно, следствие положительной селекции, помогающей человеку выжить
в борьбе против многочисленных окружающих его антигенов.
Примеры полиморфизма: для
локуса сс-цепи HLA-A идентифицировано около 50 различных аллелей; HLA-B
— 100; HLA-C — 35; HLA-DRp-цепи — 100. Но каждый человек наследует только
2 аллели: одну — от отца, вторую — от матери.
6. Каково значение нарушения
равновесия в сцеплении генов?
Комбинация аллелей в одной
хромосоме называется гаплотипом. Две комбинации аллелей 6-й хромосомы,
т. е. два гаплотипа, наследуются индивидуально: один — от матери, другой
— от отца. Анализ гаплотипов ГКГ показывает нарушение в сцеплении генов:
определенная комбинация аллелей в ГКГ наследуется с гораздо большей частотой,
чем она проявляется в популяции.
Например, многие заболевания
связаны с HLA-DR3. Существует определенное количество аллелей с нарушением
в сцеплении генов с HLA-DR3. Так, европейские HLA-DRS-гаплотипы содержат
такие же HLA-DQA1 и HLA-DQB2 аллели. Если выявлена связь HLA-DR3 с заболеванием,
то означает, что ген, ответственный за это может быть любым из числа генов,
связанных с нарушением равновесия в сцеплении генов с HLA-DR3.
7. В чем суть кодоминантного
наследования?
Для каждого локуса ГКГ человек
получает материнские и отцовские аллели. Это предпочтительнее, чем один
— альтернативный, поскольку снова повышается число возможных комбинаций
молекул комплекса гистосовместимости. Эффекты каждой экспрессированной
молекулы являются доминантными. Следовательно, гетерозиготный индивид по
определенному ассоциированному с HLA заболеванию имеет повышенную чувствительность
к данной патологии.
8. В чем смысл букв-окончаний
(А, В...) при аббревиатуре HLA?
В аббревиатурах HLA с последующим
написанием буквы через дефис, например HLA-A, обозначена специфическая
локализация гена в ГКГ, кодирующем конкретную молекулу HLA. HLA-A, HLA-B
и HLA-C описывают самые важные характеристики локуса I гена комплекса гистосовместимости.
9. Почему HLA-D получает
дополнительные обозначения буквами — R, P, Q?
Буква D характеризует внутреннюю
область II класса комплекса гистосовместимости, а не только локус одного
гена. Следовательно, чтобы описать фактически существующий локус гена,
необходимо большее количество букв. Например, HLA-DP, -DQ и -DR указывают
на локусы гена, кодирующего самые важные молекулы класса II.
Ситуацию усугубляет и то,
что каждая молекула класса II ГКГ состоит из двух отдельных полипептидных
цепей, обозначаемых а и р. Поэтому, если написано "HLA-DRA" или "HLA-DRB",
это означает локус для HLA-DR а- или (3-цепи относительно каждого в отдельности.
10. Как буквы (области)
А, В, С, D соотносятся с классом комплекса гистосовместимости?
Молекулы класса I и II главного
комплекса гистосовместимости
|
КЛАСС 1
|
КЛАСС II
|
|
|
HLA-A HLA-B
HLA-C
|
HLA-DR HLA-DP
HLA-DQ
|
|
HLA-A, -В, -С являются самыми
важными молекулами класса I ГКГ. Все молекулы HLA-D представляют класс
II; HLA-DP, -DQ и -DR — самые значимые из них. Используют и другие буквы
— Е, F, G, H, M, N, О, но они относятся к молекулам класса I (менее важным).
Необходимо знать:
• если обозначение HLA не
содержит букву D, то это означает класс I ГКГ;
• если буква D присутствует
в
любом сочетании, то это класс П.
11. Как происходит связывание
антигена?
Все антигенсвязывающие участки
имеют схожую конфигурацию. Существует углубление-борозда, стенки которой
образуют а-спирали. Группы непараллельных молекул образуют дно борозды
Р-складчатой поверхности. В Т-клеточном рецепторе и ГКГII такое строение
обуславливает наличие взаимодействия между аминоконцами а- и р-цепей. У
иммуноглобулинов антигенсвязывающий участок формируется за счет взаимодействия
аминоконцов тяжелых и легких цепей. Молекулы ГКГ типа I отличаются тем,
что антигенсвязывающий участок формируется при взаимодействии двух аминоконцов
одинаковых а-цепей.
Антигены прикрепляются как
в зоне стенок из а-спиралей, так и к р-складчатому дну. Если Т-клеточный
рецептор принимает комплекс пептидов — белок-молекула ГКГ, то он распознает
уникальную структуру и заряд антигенного белка и а-спиралей. Т-клеточный
рецептор, в отличие от антигена, не может различать детерминанты (3-складчатого
дна.
Три области с самыми значительными
генетическими отличиями (гипервариа-бельные участки) экспрессируются в
каждом сегменте а-спирали и р-складчатой области. Такая генетическая изменчивость
специфично влияет или выбирает антигены, которые могут быть связаны определенными
молекулами. К тому же, она обеспечивает специфичный "отбор" Т-клеточных
рецепторов, которые способны взаимодействовать с комплексом антиген-молекула
ГКГ, что рассматривается как трех-молекулярное взаимодействие.
Данные области коррелируют
с предрасположенностью к определенным заболеваниям. При ревматоидном артрите,
например, специфичная последовательность аминокислот гипервариабельной
области имеет высокую корреляцию с восприимчивостью к заболеванию — между
аминокислотами в позиции 67-74 HLA-DR р-цепи.
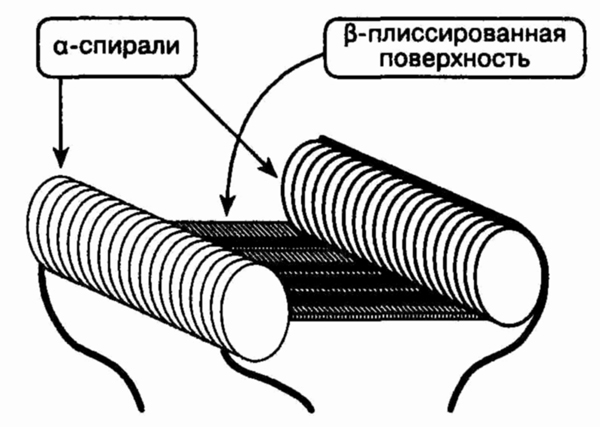
Антигенсвязывающий участок
12. Как устроены четыре
молекулы, распознающие антиген?
Иммуноглобулины, Т-клеточные
рецепторы и молекулы ГКГ класса I и II являются трансмембранными, поверхностно-клеточными
молекулами (см. рисунок). Каждая из них является димером, имеет две связанных
цепи или более. Цепи представляют собой однородную повторяющуюся структуру,
происходящую от примордиального гена, известного как "иммуноглобулиновый
суперген". У любой молекулы внекле-точно расположено амино-окончание;
внутриклеточно
— карбокси-окончание (СООН). Связывание антигена происходит около
аминоокончания молекулы. Для
любой такой молекулы существуют
гены, кодирующие необычно большое разнообразие антигенсвязывающей области.
Наибольшее разнообразие характерно для трех гапервариабельных участков
(ГВУ 1, 2 и 3), расположенных у аминотерминалов; максимально — в ГВУ
3. В отличие от этих участков, оставшиеся чрезвычайно малоизменчивы, что
способствует связыванию комплекса антиген-молекулы ГКГ и его распознаванию
Т-клеточным рецептором.
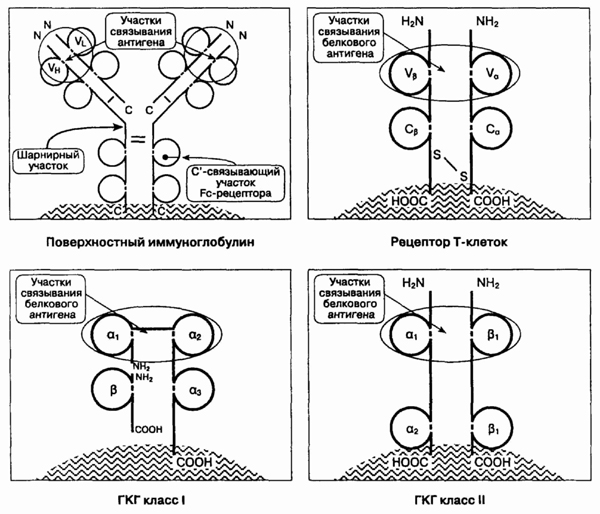
13. Почему, несмотря на
общие черты, молекулы ГКГ классов I и II необходимо различать?
Оба вида молекул клеточных
поверхностей являются димерами, но молекулы класса II обладают большим
разнообразием, чем представители класса I. И а-, и (3-цепи молекул класса
II кодируются определенной областью ГКГ класса II. И хотя а-цепи молекул
класса I кодируются аллелями ГКГ класса I, оба типа молекул (I и II классов)
имеют одинаковые р-цепи, (32-микроглобулин.
14. Каковы различия в
функциях молекул ГКГ класса I и II?
Эти молекулы отличаются клеточным
распределением; антигенными пептидными фрагментами; типом Т-клеток, распознающих
и отвечающих за антигенный комплекс, который они представляют.
Функции молекул ГКГ классов I и
II
|
|
|
|
|
|
|
КЛАСС 1
|
КЛАСС II
|
|
|
Распределение
в клетках
|
Все ядросодержащие
клетки и тромбоциты
|
Определенные
клетки иммунной системы, особенно, если они выполняют роль "профессиональных"
антигенпре-зентирующих клеток
|
|
|
|
|
В-клетки
|
|
|
|
|
Моноциты/макрофаги
|
|
|
|
|
Дендритные
клетки
|
|
|
|
|
Эпителиальные
клетки тимуса
|
|
|
|
|
Некоторые
активированные Т-клетки
|
|
|
|
|
Некоторые
клетки, в которых экспрессия
|
|
|
|
|
молекулы
ГКГ класса II может быть бы-
|
|
|
|
|
стро индуцирована,
особенно при хро-
|
|
|
|
|
нических
воспалительных процессах
|
|
|
|
|
Эндотелиальные
клетки
|
|
|
|
|
Клетки синовиальной
оболочки
|
|
|
Размеры антигена
|
8-1 3 аминокислот
(в длину)
|
1 3-25 аминокислот
(в длину)
|
|
|
Тип антигена
|
Антигенный
пептидный фрагмент, входящий в состав цитоплазмы или ядра клетки, воспроизводящих
молекулы ГКГ (т. е. эндогенные, или "собственные" пептиды; пептиды облигатных
внутриклеточных возбудителей, таких как вирусы и хлами-дии; антигены опухоли)
|
Антигенный
пептидный фрагмент лизо-сом, появившийся в результате фагоцитоза или рецепторобусловленного
эндоцитоза (т. е. экзогенный или инфекционный агент [бактерии])
|
|
|
Узнавание
Т-клетками
|
CD8+ Т-клетка
|
CD4+ Т-клетка
|
|
|
Конечный
Т-клеточный ответ
|
Клеточноопосредованная
гибель или супрессия клеток, презенти-рующих ГКГ I класса
|
Фагоцитоз,
координируемый Т-клетками, и/или ликвидация антигена антителами
|
|
|
|
|
|
|
15. Правильно ли, что
мощность и активность молекул ГКГ класса II имеют большее значение, чем
общее количество молекул ГКГ класса I?
Да. Возможности выполнения
различных функций молекул HLA-A и HLA-B примерно 50 и 100, соответственно.
Число возможностей HLA-C — почти 40. Однако даже в случае гетерозиготности
индивида в каждом аллеле а-цепи класса I общее количество молекул класса
I будет 6-3 от матери, 3 от отца (см. рисунок).
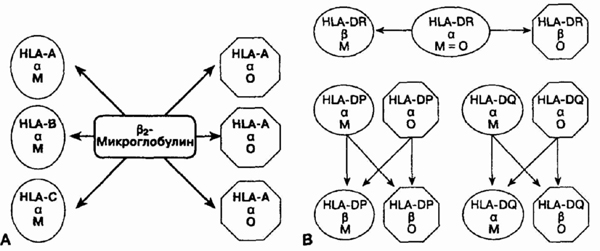
А. Наследственные варианты молекул
ГКГ класса I. В. Наследственные варианты молекул ГКГ
класса II; М — мать; О — отец
Для класса II только аллели
HLA-DR ограничено количество вариантов а-цепи. Удивителен, однако, полиморфизм
локуса а-цепи HLA-DP -DQ и локус HLA-DP, -DQ и -DR р-цепи является. В результате
количество возможных комбинаций изменчиво. У индивидов с максимальным разнообразием
будет воспроизводиться 2 молекулы HLA-DR, 4 — HLA-DP и 4 — HLA-DQ. Это
означает, что различные аллели каждого локуса класса II, кроме а-локуса
HLA-DR, которые относительно инвариантны, позволяют экспрессировать 10
типов молекул класса II.
16. Какие известны взаимоотношения
между заболеваниями и молекулами ГКГ?
HLA-антигенные связи
|
|
|
|
|
|
HLA-A3
|
Идиоматический
гемохроматоз
|
HLA-DR3 Системная
красная волчанка (СКВ)
|
|
|
HLA-A26
|
Вульгарная
пузырчатка
|
Синдром Сьегрена
|
|
|
HLA-B5
|
Болезнь Бехчета
|
Глютеновая
энтеропатия
|
|
|
|
Язвенный
колит
|
Хронический
активный гепатит
|
|
|
|
Поликистоз
почек
|
Герпетиформный
дерматит
|
|
|
HLA-B8
|
Болезнь Грейвса
|
Болезнь Грейвса
|
|
|
|
Myasthema
gravis
|
Инсулинзависимый
сахарный диабет
|
|
|
HLA-B14
|
Идиопатический
гемохроматоз
|
Идиопатический
мембранозный
|
|
|
HLA-B27
|
Серонегативная
спондилоартропатия
|
гломерулонефрит
|
|
|
HLA-B38
|
Псориатический
артрит
|
Нефропатия,
вызванная препарата-
|
|
|
HLA-DR1
|
Ревматоидный
артрит
|
ми золота
и пеницилламином
|
|
|
HLA-DR2
|
Нарколепсия
|
HLA-DR4 Ревматоидный
артрит
|
|
|
|
Множественный
склероз
|
Вульгарная
пузырчатка
|
|
|
|
Синдром Гудпасчера
|
Инсулинзависимый
сахарный диабет
|
|
|
|
|
lgA-нефропатия
|
|
|
|
|
HLA-DR5 Ювенильный
ревматоидный артрит
|
|
|
|
|
Пернициозная
анемия
|
|
|
|
|
Тиреоидит
Хашимото
|
|
|
|
|
HLA-DR7 Врожденная
гиперплазия надпочеч-
|
|
|
|
|
ников
|
|
|
|
|
HLA-DQ3.2
Инсулинзависимый сахарный диабет
|
|
|
|
|
|
|
17. Если Т-клетки регулируют
реакции при хроническом воспалении, в чем заключается предрасполагающая
роль молекул ГКГ в развитии ревматических заболеваний?
• Молекулы ГКГ являются главными
в процессе, посредством которого иммунная система "позволяет" молодым Т-клеткам
выжить и развиваться или вызывает их гибель.
• Молекулы ГКГ контролируют
действия Т-клеток. Помните, что Т-клетки "слепые" — не могут распознавать
антигены. Самостоятельно они способны специфически узнавать и, следовательно,
отвечать на внедрение инородных агентов только, если комплекс включает
белок и молекулу ГКГ.
18. Как молекулы ГКГ регулируют
способность к детекции Т-клеток?
Это осуществляется двумя
путями:
• последовательность аминокислот
в молекуле ГКГ определяет, какие белковые фрагменты антигена свяжутся с
этой молекулой. И только "отобранные" пепти-ды антигена, связанные с конкретной
молекулой ГКГ, могут быть распознаны;
• не все Т-клетки различают
молекулы ГКГ. Пептиды антигена, связанные с молекулой ГКГ класса I, распознаются
Т-клетками, имеющими CDS-молекулы на
Т-клеточных рецепторах. Молекулы
класса II, связанные с антигеном, выявляются Т-клетками, имеющими CD4-молекулы
на Т-клеточных рецепторах.
19. Правда ли, что при
наследовании HLA-DR4 ревматоидный артрит разовьется аналогично другим наследственным
заболеваниям?
Нет. В отличие от заболеваний,
которые передаются по аутосомно-доминантному или рецессивному типу, а также
в случаях отсутствия или мутации гена, вызывающего дефицит функции жизненно
важного фермента, возникновение большинства HLA-связанных болезней не удается
объяснить таким образом. Очевидно, что некоторые молекулы HLA никогда не
становятся причиной или подтверждением восприимчивости к заболеванию, с
которым они связаны. И наоборот, они связаны с общим типом наследования
для нескольких генов, что проявляется в предрасположенности к конкретному
заболеванию — феномен нарушения сцепления с геном. Однако иногда
наличие конкретных HLA-молекул подтверждает повышенную восприимчивость
к заболеванию, с которым они ассоциируются.
20. Если ген молекул HLA
не является причиной заболевания, возможно существует другой ген, о котором
мы еще не знаем, вызывающий заболевание? Как это выяснить?
Обследование близнецов дает
ясный ответ на этот вопрос. Если доказана связь наследуемого гена с заболеванием,
то патология разовьется у обоих близнецов. Близнецы с экспрессией HLA-DR4,
генетически связанного с ревматоидным артритом, имеют достоверно высокий
риск возникновения этого заболевания. Однако у многих людей, имеющих HLA-DR4,
никогда не развивается данная патология, несмотря на то, что им страдают
сибсы (родные братья и сестры).
Доказано, что многие молекулы
HLA — не просто наследственные "свидетели". При анализе распространенности
заболеваний у гетерозигот и гомозигот установлено, что эффекты молекулы
HLA "доминантные", поскольку наследственное заболевание развивается даже
у гетерозигот. Однако индивиды-гомозиготы с частичным наследованием гена
все же больше подвержены заболеванию, чем гетерозиготы. Такие исследования
кодоминантной
экспрессии ГКГ убеждают, что HLA важен в патофизиологии аутоиммунных
заболеваний.
Исследования на крысах генетически
чистых линий позволяют выявить иммуно-патогенетические взаимосвязи между
HLA и заболеванием. Эти животные — транс-генные В27 крысы Льюис — являются
генетически запрограммированными на экспрессию HLA-B27 в клетках. Как следствие,
спонтанно развивающиеся поражения кишечника, кожи, ногтей, суставов, мочевыводящих
путей и позвоночника. У человека серонегативные спондилоартропатии также
сочетаются с HLA-B27.
21. Почему предполагается,
что сочетающийся с ревматическим заболеванием ген не вызывает этой патологии,
но повышает восприимчивость к ней?
Хотя известно, что некоторые
молекулы HLA связаны с определенными заболеваниями, не обязательно, что
заболеет каждый индивидуум с экспрессией молекулы HLA. Определенные гены
могут повышать восприимчивость к конкретным заболеваниям, хотя и не являются
их причиной. Установлено также, что негенетические факторы, такие как инфекции,
четко связаны с возникновением ряда HLA-ассоциированных заболеваний. Не
исключены эффекты других факторов, воздействующих на макроорганизм и окружающую
его среду, которые способствуют развитию заболевания у человека с наследственной
предрасположенностью.
22. Каков механизм проявления
восприимчивости к заболеванию?
Ответ на этот вопрос потребует
больших финансовых затрат. Поэтому пока вопрос остается без ответа.
23. Как определить достоверность
связи между заболеванием и HLA?
Риск развития болезни, связанной
с HLA, рассматривается как относительный. Например, относительный
риск описывается как соотношение (%) количества HLA-ОК4-позитивных людей
(возможно у них разовьется в будущем ревматоидный артрит) и количества
индивидов, не являющихся НЬА-ВК4-позитивными:
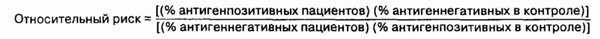
Относительный риск зависит
в том числе и от этнического состава обследуемой популяции. Например, риск
ревматоидного артрита среди Н1_А-ОК4-позитивных белых в Северной Европе
значительно выше, чем у НЬА-ОК4-позитивных евреев.
24. Как определить HLA-тип
пациента?
Наличие HLA-DR3 или HLA-DR4
рассматривается как "серологическая" особенность. При пересадке органов
и беременности их определяют методом парных сывороток, обнаружение в которых
антител к молекулам ГКГ предварительно расценивается как положительный
ответ. Существуют сыворотки, содержащие антитела только против HLA-DR2,
HLA-DR3 и HLA-DR4 и т. п. Комбинация парных сывороток получила название
"тип" и является характеристикой индивидуальных молекул комплекса ГКГ.
Этот метод широко используется, особенно в трансплантологии, но в настоящее
время предложены более специфичные генетические методы, применяемые для
выявления ГКГ-идентичности человека и анализа иммуногенетических связей
с заболеваниями.
25. Что такое перекрестная
реактивность в серологическом типировании?
Антитела к молекулам HLA,
полученные из сыворотки человека, способны связать похожие, но не идентичные
молекулы. По мере развития серологических методов исследования стало ясно,
что антитела против молекул комплекса гистосовместимости не определяют
специфичный небольшой участок молекулы, "ответственный" за предрасположенность
к аутоиммунному заболеванию. Если большинство молекул HLA-DR4 идентичны
в определенном участке, повышающем предрасположенность к ревматоидному
артриту, тогда большинство HLA-DR4-no3HTHBHbix индивидов имеют повышенную
предрасположенность к нему. В противоположность сказанному выше, два индивида,
один HLA-DR4-no3HTHBHbra, другой HLA-DRl-позитивный, могут иметь одинаковую
предрасположенность к возникновению ревматоидного артрита, если у них имеется
одинаковый участок, "облегчающий" возникновение ревматоидного артрита,
несмотря на их серологические особенности.
26. Действительно ли существуют
Н1А-ОК4-позитивные субъекты, не предрасположенные к повышенной заболеваемости
ревматоидным артритом? Существуют ли индивиды, не имеющие HLA-DR4, но обладающие
HLA-DR1, -DR6 или -DR10, и поэтому предрасположенные к ревматоидному артриту?
Да. Подобная перекрестная
реактивность и, следовательно, недостоверная специфичность серотипирования
требуют более точного генетического типирования сыворотки. Можно определить
нуклеотидную последовательность локусов генов комплекса гистосовместимости,
например с помощью DRB*0402. Они, вероятно, будут
более специфичны для определенной
области молекулы HLA, которая ответственна за предрасположенность к заболеванию
— часть эпитопа (отдельная антигенная детерминанта). Эти методы
улучшают оценку относительного риска.
Наличие перекрестной реактивности
существенно затрудняет изучение ревма-тоидного артрита. В различных этнических
группах установлена связь между молекулами HLA-DR1, -DR4, -DR6 и DR10 и
ревматоидным артритом. Молекулы HLA-DR4 гомологичны в первом и втором гипервариабельных
участках, дают одинаковый результат при серологическом типировании (гомологичность
в 1 и 2 гипервариабельных участках, характеризуется верхними четырьмя последовательностями
[рисунок]). Некоторые аллели HLA-DR4, -DR1, -DR6 и -DR10 очень различаются
в 1 и 2 гипервариабельных участках, но удивительно гомологичны по аминокислотному
составу в третьем гипервариабельном участке (3-й гипервариа-бельный участок
в нижних шести последовательностях). Этот "общий эпитоп" в 3-м участке
предрасполагает к развитию ревматоидного артрита. С другой стороны, последовательность
HLA-DRB*0402 (верхняя последовательность на рисунке) не формирует предпосылок
к развитию ревматоидного артрита. В аллеле DRB*0402 имеются аминокислоты
изолейцин (I), аспарагиновая кислота (D) и глютаминовая кислота (Е), в
положениях 67, 70 и 71, соответственно. Предрасположение к возникновению
ревматоидного артрита бывает при наличии лейцина (L) в 67-й позиции, глутамина
(Q) или аргинина (R) в 70-й; аргинина (R) или лизина (К) в 71-й; и аланина
(А) в 74-й.
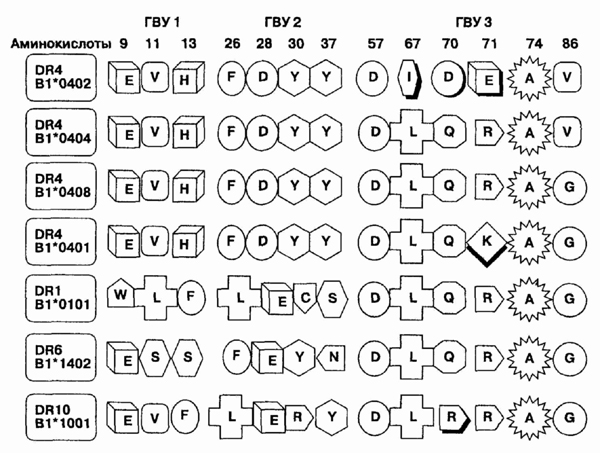
Последовательность аминокислот в трех
гипервариабельных участках нескольких разных аллелей HLA-DR р-цепи
Избранная литература
Abbas А. К., Lichtman A.
H., Pober J. S. The major histocompatibility complex. In: Abbas A. K.,
Lichtman A. H., Pober J. S. (eds). Cellular and Molecular Immunology, 2nd
ed. Philadelphia, W. B, Saunders 1994, 96-115.
Carson D. A. Genetic factors
in the etiology and pathogenesis of autoimmunity. FASEB J., 6: 2800-2805;
1992.
Goodman J. W. Antigen presentation
and the major histocompatibility complex. In: Stites D. P., Terr A. I.,
Parslow T. G. (eds). Basic and Clinical Immunology, 8th ed. Norwalk, CT,
Apple-ton & Lange, 1994, 58-65.
Nepom B. S., Nepom G. T.
Immunogenetics of the rheumatic diseases. In: Kelley W. K., Harris E.,
Ruddy S., Sledge C. B. (eds). Textbook of Rheumatology, 4th ed. Philadelphia,
W. B. Saunders, 1993, 89-107.
Nepom B. S. The role of the
major histocompatibility complex in autoimmunity. Clin. Immunol. Immunopathol.,
67: S50-S55,1993.
Robinson D. M, Nepom G. T.
The major histocompatibility complex and disease susceptibility. Immunol.
Allergy. Clin. North Am., 13: 255-272, 1993.
Salazar M., Yunis E. J. MHC:
Gene structure and function. In: Frank M. M., Austen K. F., Cla-man H.
N., Unanue E. R. (eds). Samter's Immunologic Diseases, 5th ed. New York,
Little, Brown and Company, 1994,101-106.
Weyand C. M., GoronzyJ. J.
Functional domains on HLA-DR molecules: Implications for the linkage of
HLA-DR genes to different autoimmune diseases. Clin. Immunol. Immunopathol.,
70:91-98,1994.
Winchester R.J. Immunogenetics.
In: Schumacher H. R. (ed.). Primer on the Rheumatic Diseases, 10th ed.
Atlanta, Arthritis Foundation, 1993, 35-40.
Winchester R.J. The molecular
basis of susceptibility to rheumatoid arthitis. Adv. Immunol., 65: 389-466,1994.
ГЛАВА 7. ТОЛЕРАНТНОСТЬ
И АУТОИММУНИТЕТ
Nicholas J. Battafarano, M.D.
1. Что такое толерантность?
Нормально функционирующая
иммунная система должна распознавать и уничтожать определенные антигены,
которые причиняют вред или даже вызывают гибель макроорганизма. Не менее
важно отличать и не уничтожать антигены, которые необходимы организму.
Толерантность
—
термин, применяемый для описания феномена антиген-специфической невосприимчивости.
Это
означает, что иммунная система не уничтожает определенные антигены.
2. Толерантность — это
врожденное или приобретенное свойство?
Толерантность характеризуется
специфичностью и памятью, т. е. иммунная система "обучается" толерантности
по отношению к некоторым специфическим антигенам
организма и интолерантности
ко многим посторонним антигенам. При рассмотрении аутоиммунных нарушений
это понятие часто сужается до толерантности к аутоанти-генам, таким
как собственные нуклеопротеины или поверхностно-клеточные молекулы. Однако
феномен толерантности не ограничивается аутоантигенами. Толерантность к
экзогенным антигенам (белки пищи) является решающим фактором для выживания
индивида. Несомненна ценность знаний о развитии и потери толерантности
при аутоиммунных нарушениях, так же как и разработка методов терапевтического
воздействия, основанных на понимании механизмов толерантности к экзогенным
белкам.
3. Что такое аутоиммунитет?
Термин "аутоиммунитет" является
общеупотребимым для определения состояний, при которых индивид становится
жертвой собственного иммунного ответа. Аутоиммунитет можно рассматривать
как отсутствие нормальной аутотолерантности. Аутоиммунные нарушения
являются антигенвызванными процессами, которые характеризуются специфичностью
и памятью. И наоборот, аутоиммунный процесс предполагает узнавание экзогенного
или эндогенного антигена иммунной системой, за которым следует атака на
собственные антигены (аутоантигены). Эти процессы развиваются у индивида,
ранее имевшего толерантность к тем антигенам, которые теперь становятся
целью иммунной реакции. Следовательно, лучше большинство аутоиммунных процессов
характеризовать не просто как отсутствие, а как утрату толерантности.
4. Если аутоиммунные процессы
включают потерю или отсутствие толерантности, которые приводят к стойкому
управляемому антигеном иммунному ответу на аутоантигены, то существуют
ли механизмы предотвращения потери или восстановления толерантности?
В справедливость положительного
ответа верят многие исследователи. Достоверное подтверждение этой гипотезы
предполагает понимание механизмов развития и поддержания толерантности.
Наблюдений, подтверждающих, что толерантность развивается, поддерживается,
но может быть и утрачена, достаточно. Однако понимания механизмов этих
процессов нет. Есть только фрагменты головоломки, но мы не знаем, как их
собрать вместе. Поэтому современная терапия нарушений направлена только
на отдельные этапы процесса.
5. Каковы основные факторы,
влияющие на развитие специфического иммунного ответа?
• Характеристики антигена,
вовлеченного в специфический иммунный ответ.
• Свойства дополнительных
клеток, которые первично взаимодействуют с антигеном.
• Природа (свойства) лимфоцитов
и синтезируемых ими цитокинов, участвующих в ответе.
6. Почему антиген скорее
вызовет развитие толерантности, чем аутоиммунную реакцию?
Антиген может "выбирать"
определенные типы иммунных ответов на основе своей химической структуры;
первоначального количества, с которым сталкивается организм; пути поступления;
и среды, внутри которой антиген взаимодействует с иммунной системой. Два
важных аспекта среды включают степень развития иммунной системы с антигеном
и наличие или отсутствие окружающего воспаления при первом контакте.
|
ТОЛЕРАНТНОСТЬ
|
ИММУННЫЙ
ОТВЕТ
|
|
|
Полисахариды
В/в или оральный путь поступления Большая доза Иммунологическая незрелость
|
Белки П/к
или внутрикожный путь поступления Небольшая доза Окружающее воспаление
|
|
Например, иммунный ответ
чаще развивается на внедрение чужеродных белков, нежели полисахаридов.
Небольшие подкожные или внутрикожные дозы способны вызывать больший иммунный
ответ, чем значительная доза того же антигена, введенная внутривенно или
принятая внутрь. Если в месте внедрения антигена присутствует воспаление
(антиген введен с адъювантом), то более вероятно развитие иммунного ответа.
Если же воспаления нет или иммунные клетки, которые подверглись воздействию,
являются незрелыми к моменту встречи с антигеном, то сформируется толерантность.
7. Какова роль молекул
ГКГ в развитии аутоиммунных заболеваний?
Во-первых, абсолютное большинство
антигенов, способствующих развитию аутоиммунных заболеваний, являются белками.
Антигенспецифические реакции памяти на белки (гуморальные, фагоцитозные
или цитотоксические) регулируются Т-клетка-ми. Однако Т-клетки могут только
распознавать белковые антигены, представляющие собой молекулы ГКГ; последние
выполняют несколько важных функций:
1. Они переводят неспецифические
иммунологические ответы клеток в специфические.
2. Молекулы ГКГ играют роль
связующего фактора. Например, антиген-специфические В-клетки, которые опознали
антиген посредством своего поверхностного иммуноглобулинового рецептора,
передают специфическую информацию Т-клетками через молекулы комплекса гистосовместимости.
Это выдвигает молекулы комплекса
гистосовместимости на центральное место в процессе развития или недоформирования
иммунного ответа. При его дефектах на уровне молекул ГКГ развитие и сохранение
толерантности в полном объеме невозможно.
8. Как изменение аминокислотной
последовательности антигена влияет на развитие аутоиммунного заболевания?
Существенное значение имеет
не только то, что антигены являются белками, но важна также последовательность
расположения аминокислот. В тех случаях, когда молекулы комплекса гистосовместимости
класса I и II презентируют белки Т-клет-кам, то только пептиды небольшого
размера соответствуют антигенсвязывающей щели — 8-13 аминокислот для класса
I и 13-25 для класса II. Очевидно, что индивидуальные позиции аминокислот
в молекуле ГКГ могут иметь принципиальное значение для связывания определенных
комплементарных последовательностей аминокислот в белках.
9. Как первичная структура
антигена влияет на процесс потери толерантности?
Во-первых, пептидная последовательность
инородного антигена может быть похожа на таковую у собственного антигена.
Если это явление имеет место, то не исключено развитие неблагоприятных
последствий. Классическим примером считаются ревматические заболевания
сердца. Миокардиальные аутоантигены — миозин и сарколеммные белки — напоминают
структуру белка стрептококка М. Звенья патогенеза, поддерживаемые аутоантителами,
могут быть вторичными по отношению к интактной ткани миокарда, которая
становится мишенью иммунного ответа, за счет антител, образование которых
вызвано М-протеином. В дальнейшем уже аутоантигены миокарда поддерживают
этот процесс.
Другой пример. Существуют
пептиды, источником которых являются несколько возбудителей, последовательность
аминокислот которых идентична последовательности в антигенсвязывающей щели
определенных молекул комплекса гистосовмес-тимости. Так, ряд из пяти аминокислот
в пептиде (плазмиде) Shigella/lexneri идентичен последовательности
в HLA-B27, выявленной у пациентов с этой инфекцией и синдромом Рейтера.
Наличие подобной гомологичности установлено или предполагается для многих
других пептидов, источником которых являются микроорганизмы.
Существуют два примера перекрестной
реактивности, в которых продукты иммунного ответа на инородный антиген
ошибочно реагируют с собственными антигенами индивида. Это явление называется
молекулярной
мимикрией. Клоны Т- и В-клеток, первоначально "возбужденные" инородным
антигеном, продолжают стимулироваться реагирующими перекрестно аутоантигенами.
Аутоантигенные иммунные реакции продолжаются в течение длительного времени
после того, как инородный антиген, запустивший этот процесс, уже выведен
из макроорганизма.
10. Как количество и способ
передачи антигена влияет на индукцию иммунного ответа?
Большие дозы белков или полисахаридов
определяют, какой тип толерантности возникнет — Т- или В-клеточная. При
адекватном клеточном взаимодействии презентация пептидов в низких дозах
может вызывать Т-клеточную толерантность.
Недавно проведены исследования
с введением антигена внутрь с целью повышения толерантности к эндогенным
антигенам. Например, в экспериментах по моделированию аллергического энцефаломиелита
(множественного склероза) на животных было установлено, что основной белок
миелина (ОБМ) является аутоантигеном-ми-шенью. Лечение животных ОБМ, вводимым
внутрь, купировало это тяжелое заболевание. Результаты экспериментов позволили
начать клинические испытания применения ОБМ у людей, страдающих аутоантигенным
множественным склерозом. Аналогичный подход возможен в отношении пациентов
с ревматоидным артритом, которым назначают коллаген внутрь для стимулирования
толерантности.
11. Что такое суперантигены?
Вызывают ли они формирование аутоиммунитета?
Суперантигенами называются
экзогенные антигены, особенно бактериального или ретровирусного происхождения,
способные связываться с Т-клеточным рецептором и молекулами комплекса гистосовместимости
класса II вне зоны антигенсвязывающей борозды и соединять эти образования
вместе (см. рисунок). Эти антигены, в отличие от типичных, не ограничены
в своих эффектах. Они не нуждаются в обработке и во взаимодействии с антигенсвязывающей
щелью молекул комплекса гистосовместимости для последующей стимуляции Т-клеток.
Суперантигены обладают специфичностью в отношении сегмента в гипервариабельной
области (V) (3-цепи Т-кле-точного рецептора, т. е. У|3-областью. До 10
% Т-клеток имеют одинаковую Vp-область, для которой суперантиген специфичен.
Это приводит к активации очень большого числа различных антигенспецифических
клонов Т-клеток.
Суперантигены вовлечены в
патогенез инфекционно-токсического шока при стафилококковой инфекции, но
не участвуют в развитии классических ревматических заболевании. Бактериальные
липополисахариды функционируют как поликлональ-ные активаторы В-клеток,
включая аутореактивные В-клетки. Возможно, липополисахариды играют определенную
роль в аутоиммунных заболеваниях (как минимум в определенные периоды болезни),
но это еще не доказано.
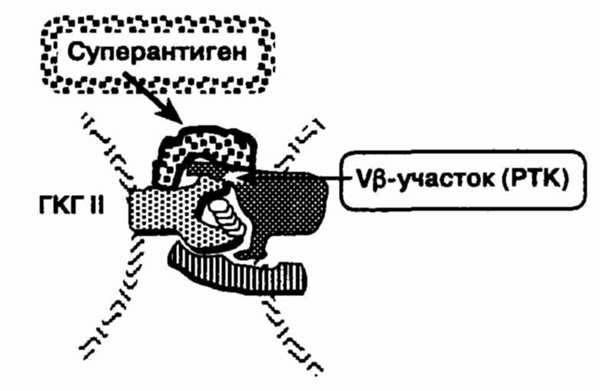
Специфичность суперантигена в отношении
vp-участка Т-клеточного рецептора, расположенной снаружи от связывающей
щели молекулы ГКГ
12. Как влияет окружающая
среда на развитие иммунных ответов?
Давно известно, что эффективность
иммунизации повышается при использовании адъювантов. Однако антигены, по
отношению к которым индивидуум был ранее то-лерантен, иногда "безвредно"
презентируются лимфоцитам в зонах, уже существующего воспаления. Это может
быть результатом повышенной и аберрантной презентации антигенов из-за стимуляции
цитокинами антигенпрезентирующих клеток. В этом случае может возникать
потеря толерантности. Затем наблюдается длительное персистирование аутоантигенного
специфического иммунного ответа после ликвидации пускового механизма первичного
воспалительного процесса.
13. Что такое детерминантное
распространение?
Этот термин используется
для описания феномена, представленного в 12-м вопросе. Семейную ссору можно
рассматривать как аналогию процессу, в котором острая воспалительная реакция
провоцирует развитие более тяжелого и хронического воспаления. Когда преобладает
рассудок, обсуждение направлено на поиск эффективных решений. Однако иногда
дискуссия переходит в долгое противостояние. Неожиданно каждое ее положение
становится угрожающим. (Ситуации, которые супруги раньше преодолевали спокойно,
теперь вызывают бурный всплеск эмоций.) Нередко причина конфликта быстро
забывается после установления истины, а существовавшую ранее толерантность
(терпимость, если речь идет о семье) уже не вернуть из-за многих якобы
"безвредных" факторов.
Детерминантное распространение
описывает потерю толерантности за счет активной продолжающейся аутоантигенной
специфической иммунной реакции на целый ряд антигенов, присутствующих в
очаге острого и хронического воспаления. Существуют доказательства зрелости
аутореактивных Т- и В-клеточных ответов на разнообразные аутоантигены при
хроническом аутоиммунном заболевании.
14. Что означает термин
"латентные антигены"?
Латентные антигены являются
потенциальными антигенами, которые могут быть никогда не распознаны иммунной
системой. Следовательно, это типично внутриклеточные антигены, способные
вызывать агрессивный или толерантный иммунный ответ.
Они иногда являются причиной
аутоиммунной реакции при продолжающемся воспалении, приводящем к разрушению
клеток, когда латентный антиген становится доступен и воспринимается как
экзогенный.
15. Как добавочные клетки
"поощряют" развитие в большей степени толерантности, чем аутоиммунитета?
Антигенпрезентирующие клетки
часто называются "вспомогательными", поскольку они как бы снабжают лимфоциты.
Конечно, Т-лимфоциты выполняют важнейшие функции, но считать их самыми
главными, вероятно, нельзя. Находятся ли Т-клетки под контролем? Наличие
антигенпрезентирующих клеток дает положительный ответ. Антигенпрезентирующие
клетки всего лишь точно выявляют, что и когда им необходимо обнаружить.
Они представляют информацию о том, что обнаружено, возможно ли ограничение
процесса и "кто" это должен делать. Почти во всех случаях эти клетки должны
авторизировать ответ лимфоцитов — феномен известный как кости-муляция.
Антигенпрезентирующие клетки
важны в процессе выбора конкретных Т-клеток и поддержания толерантности
в течение жизни. Они определяют характер процес-синга и презентирования
антигенов; молекулы ГКГ, которым они презентируют антигены; интенсивность
и образование усиливающих стимулов. Если антигенпрезен-тирующие клетки
не функционируют должным образом или они неправильно восприняты другими
клетками, возможно усиление аутоиммунитета.
16. Назовите возможные
функции молекул ГКГ в аутоиммунном процессе.
Постулировано наличие многих
механизмов. Ни один из них в отдельности не объясняет возникновение аутоиммунитета.
Влияние молекул комплекса гистосовместимости
на развитие аутоиммунных нарушений
|
|
|
|
|
ФУНКЦИЯ В
АУТОИММУНИТЕТЕ
|
ОБЪЯСНЕНИЕ
|
|
|
Систематическая
ошибка в выборе Т-клетки
|
Популяция
Т-клеток выбирается через наследуемые, сцепленные с заболеваниями молекулы
комплекса гистосовместимости и может включать более аутореактивные Т-клетки
или аутореактивные клетки, специфичные для определенного заболевания
|
|
|
Патогенетические
нарушения функции рецептора
|
Определенные
молекулы ГКГ, связанные с заболеваниями, могут функционировать в качестве
рецепторов для некоторых патогенов, вызывающих аутоиммунные заболевания
|
|
|
Определение
необычных пептидов
|
Молекулы
ГКГ, ассоциированные заболеванием, способны к презентации пептидов, что
вызывает аутоиммунный ответ. Это предположение поддерживается эпитопной
гипотезой
|
|
|
Молекулярная
мимикрия
|
Экзогенные
антигены или другие молекулы ГКГ + экзогенный пептид напоминают молекулы
ГКГ, связанные с заболеваниями, в сочетании с или без прикрепленного к
ним пептида. Это приводит к следующим событиям За нормальным иммунным ответом
возникает патологическая аутореактивность или Иммунная система,
толерантная к собственным молекулам ГКГ с или без связанного пептида, не
может правильно реагировать на внедрение перекрестно-реактивного экзогенного
антигена, который становится причиной хронического заболевания
|
|
|
Неправильная
презентация пептидов
|
Презентация
собственных антигенов, когда антигенпрезенти-рующие клетки также экспрессируют
костимулирующие молекулы, или стимуляций цитокинами иммунного ответа Презентация
пептидов, подвергнутых неадекватному процес-сингу Повышенная презентация
пептидов, не требующих ответа, возникает после их стимуляции антигенпрезентирующими
цитокинами
|
|
17. Что такое клопальная
делеция?
Клоны Т-лимфоцитов не приносят
пользы, если они не способны распознать "свой комплекс гистосовместимости"
или узнают, но пытаются уничтожить его. Другими словами, определение Т-клеточным
рецептором пептидов комплекса молекула ГКГ-пептид не может быть "приблизительным",
а должно быть точным. В противном случае, Т-клетки часто самоуничтожаются.
Клональная
делеция относится к процессу, происходящему в вилочковой железе, когда
незрелые Т-клетки, рецепторы которых не получают точной настройки, подвергаются
самоуничтожению. Эти и другие функционально неполноценные клетки исчезают
из клона Т-клеток.
18. Как в тимусе происходит
отбор Т-клеток на выживание или уничтожение?
Этот процесс имеет как минимум
две составляющих:
1. Клетки должны быть положительно
выбраны. Т-клеточный рецептор должен распознавать "свой комплекс гистосовместимости
+ пептид", чтобы прореагировать в случае необходимости. Обладающие этими
качествами клетки выживают, остальные уничтожаются.
2. Т-клетки должны быть отрицательно
выбраны. Они не должны обладать таким высоким сродством к комплексу
гистосовместимости, чтобы не реагировать на "свой комплекс гистосовместимости
+ пептид". Клетки, которые при взаимодействии являются "слишком горячими",
уничтожаются или инактивируются.
19. Как клетки нацеливаются
на самоуничтожение? Если самоуничтожения не происходит, приводит ли это
к развитию аутоиммунного заболевания?
Согласно современным представлениям,
аутореактивные Т-клетки не могут быть удалены из-за того, что управление
этим процессом неэффективно. Механизм, программирующий самоуничтожение
клеток, называется апоптоз. Он инициируется связыванием с поверхностно-клеточной
молекулой, называемой Fas/APOl (CD95). Дефект Fas-опосредованного апоптоза
является генетическим дефектом при системной красной волчанке (в эксперименте
на мышах). Предполагается, что аберрантный Fas-опосредованный апоптоз также
может обусловливать возникновение системной красной волчанки у человека.
20. Что такое клональная
анергия?
Известно, что селекция и
обучение Т-клеток не ограничиваются только вилочковой железой. В кровотоке
и вторичных лимфоидных тканях присутствует множество потенциально аутореактивных
Т-клеток. Клональная анергия — это процесс, происходящий в вилочковой
железе или в периферических тканях, заключающийся в функциональной инактивации,
но не уничтожении, аутореактивных Т-клеток. Иначе говоря, это процесс,
посредством которого аутореактивные Т-клетки инактивируются или "обучаются"
узнавать антигены, но не отвечать на их внедрение.
21. Как возникает клональная
анергия?
Точно неизвестно Однако в
основе любых иммунологических процессов лежат повторяющиеся сигналы Большинство
реакций, связанных с клеточной активацией, особенно антигенспецифические,
требуют более чем одного сигнала Предполагается, что энергические процессы
включают взаимодействие комплекса молекула ГКГ-пептид с аутореактивным
Т-клеточным рецептором, во время которого костимуля-торные сигналы не доводятся
до аутореактивных Т-клеток
22. Относится ли термин
"Т-клетки-супрессоры" к некоторым формам Т-клеточ-ной толерантности?
Представление о Т-клетках-супрессорах
неоднозначно Существует определенная настороженность в отношении к этим
клеткам, поскольку наблюдалось перемещение антигенспецифичной иммунологической
супрессии при пассивном пассаже Т-клеток Возможно, существует особый тип
Т-клеток, осуществляющих только супрес-сорные функции
Феномен антигенспецифичной
супрессии в иммунных ответах несовместим с определением толерантности,
поскольку это требует специфичной активации Т-клеточ-ного ответа для получения
супрессии Иммунологическая толерантность — дефект клеточной активации,
существующий несмотря на наличие антигенспецифического распознавания Антигенспецифические
Т-супрессорные эффекты, возможно, через освобождение фактора роста опухоли-р
способны модифицировать аутореактив-ность Сложно выявить этот эффект как
функцию особых Т-клеток
23. Существует ли "В-клеточная
толерантность"?
Да, В-клеточная толерантность
действительно существует В настоящее время ее механизмы активно изучаются
Предполагается, что незрелые В-клетки, специфичные в отношении антигенов
организма, чаще блокируются в процессе развития, нежели уничтожаются Высокие
дозы полисахаридов, в противоположность пептидам для Т-клеток, способствуют
формированию В-клеточной толерантности Неожиданная встреча с антигеном
при отсутствии содействия со стороны специализированных Т-клеток, особенно
в ранний период развития В-клеток, ответственна за некоторые формы В-клеточной
толерантности Предполагается, что потеря В-клеточной толерантности
может возникать без содействия Т-клеток В то время как Т-клеточная анергия
существует длительно, поддержание В-клеточной анергии требует более частого
воздействия антигена
24. Как задействованы
аутоантитела в патогенезе заболеваний?
Как упоминалось ранее, установлено
наличие аутореактивных лимфоцитов, В- и Т-клеток Это же относится и к выработке
аутоантител (ревматоидные факторы и антиядерные антитела), содержание которых
временно повышается при активации иммунитета Этот механизм регуляции считается
нормальным явлением С увеличением возраста человека увеличивается выработка
аутоантител, что, возможно, отражает некоторые нарушения поддержания толерантности
Эта гиперпродукция происходит параллельно с повышением числа аутоиммунных
заболеваний по мере старения, но без вовлечения аутоантител в патогенез
всех аутоиммунных заболеваний
25. Назовите заболевания,
при которых аутоантитела играют основную патогенетическую роль.
• Аутоантитела являются основным
фактором, повреждающим клетки, при некоторых формах гемолитических анемий
и аутоиммунных тромбоцитопений
• При инсулинрезистентном
сахарном диабете, ту asthenia gravis, пернициозной анемии аутоантитела
непосредственно воздействуют на клеточные рецепторы, что вызывает патологический
клеточный ответ
• При синдроме Гудпасчера
и буллезной пузырчатке антитела воздействуют на базальную мембрану, что
является основным патологическими компонентом при этих заболеваниях.
• При системной красной волчанке
и постстрептококковом гломерулонефрите иммунные комплексы, вызывая появление
аутоантител, повреждают почечные клубочки
• При других заболеваниях
сочетание определенных антител с заболеваниями или частичными проявлениями
этих заболеваний не всегда приводит к возникновению патологии
Избранная литература
Abbas А К , Lichtman A H.PoberJ
S Immune-mediated injun and disease In Abbas A K, Lichtman A H , Pober
J S (eds) Cellular and Molecular Immunology, 2nd ed Philadelphia W В Saunders,
1994, 393-408
Abbas А К , Lichtman A H
, Pober J S Self-tolerance and autoimmunity In Abbas А К , Lichtman A H
, Pober J S (eds) Cellular and Molecular Immunology, 2nd ed Philadelphia,
W В Saunders, 1994, 376-392
Fowlkes В J , Ramsdell F
T-cell tolerance Curr Opm Immunol, 5 873-879, 1993
Holman H R Through barriers
to understanding rheumatic diseases Arthritis Rheum, 37 1565-1572,1994
Kotb M Infection and autoimmunity
A story of the host, the pathogen, and the copathogen Clm Immunol Immunopathol,
74 10-22,1995
LasalleJ M , Hafler D A T-cell
anergy FACEBJ.8 601-608, 1994
Mountz J D , Wu J , Cheng
J , Zhou Т Autoimmune disease A problem of defective apoptosis Arthritis
Rheum, 37 1415-1420,1994
NemazeeJ D Promotion and
prevention of autoimmunity by В lyphocytes Curr Opm Immunol, 5 866-872,1993
Ridgway W M , Wemer H L ,
Fathman С G Regulation of autoimmune response Curr Opm Immunol, 6 946-955,1994
Schwartz В D Structure, function,
genetics of the H LA complex m rheumatic disease In Mc-Carty D J , Koopman
W J (eds) Arthritis and Allied Conditions A Textbook of Rheumatology, 12th
ed Philadelphia, Lea & Febiger, 1993,509-523
SercarzE E.DattaS К Mechanisms
of autoimmunisation Perspective from the mid 90's Curr Opm Immunol, 6 875-881,1994
ShurP H Arthritis and autoimmunity
Arthritis Rheum , 37 1818-1825,1994
StembergA D Mechanisms of
disordered immune regulation In StitesD P, Terr A I, Parslow Т G (eds)
Basic and Clinical Immunology, 8th ed Norwalk, CT, Appleton & Lange,
1994, 380-386
|
