| ГЛАВА 73. РАДИО-, ЭХОГРАФИЧЕСКИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
1. Какие визуализирующие
методы используются при проведении чрескожной биопсии?
Основными визуализирующими
методами, применяемыми при выполнении чрескожной биопсии, являются рентгеноскопия,
ультразвуковое сканирование и компьютерная томография. Кроме того, так
как в последние годы стало возможно четко визуа-лизировать мягкие ткани
с помощью магнитно-резонансной томографии (МРТ), появилось множество систем,
позволяющих выполнять биопсию под контролем МРТ. Биопсия тканей под контролем
МРТ пока не получила широкого распространения, но, несомненно, этот метод
будет играть важную роль в будущем. Основными факторами, определяющими
выбор конкретного метода визуализации для выполнения биопсии тканей, являются:
(1) возможность обнаружения патологических очагов, из которых необходимо
произвести забор биопсийного материала для морфологического исследования,
а также расположение этих очагов по отношению к близлежащим органам; (2)
доступность пораженного участка и (3) необходимость выполнения биопсии
в отделении интенсивной терапии.
Компьютерная томография
(КТ), позволяющая четко дифференцировать различные ткани организма, является
идеальным методом исследования забрюшинных образований и глубоко расположенных
образований небольшого размера, особенно окруженных кровеносными сосудами
и петлями кишки. Рентгеноскопия и ультразвуковое исследование (У ЗИ) позволяют
осуществлять постоянный контроль во время проведения биопсии, выполняются
быстрее и являются менее дорогостоящими исследованиями по сравнению с компьютерной
томографией. Рентгеноскопия и У ЗИ являются методами выбора при выполнении
биопсии поверхностно расположенных образований большого размера (см. рисунок).
Кроме того, хорошая переносимость УЗИ пациентами и портативные размеры
аппаратов позволяют использовать данный метод при обследовании тяжело больных
пациентов, находящихся в отделении интенсивной терапии.
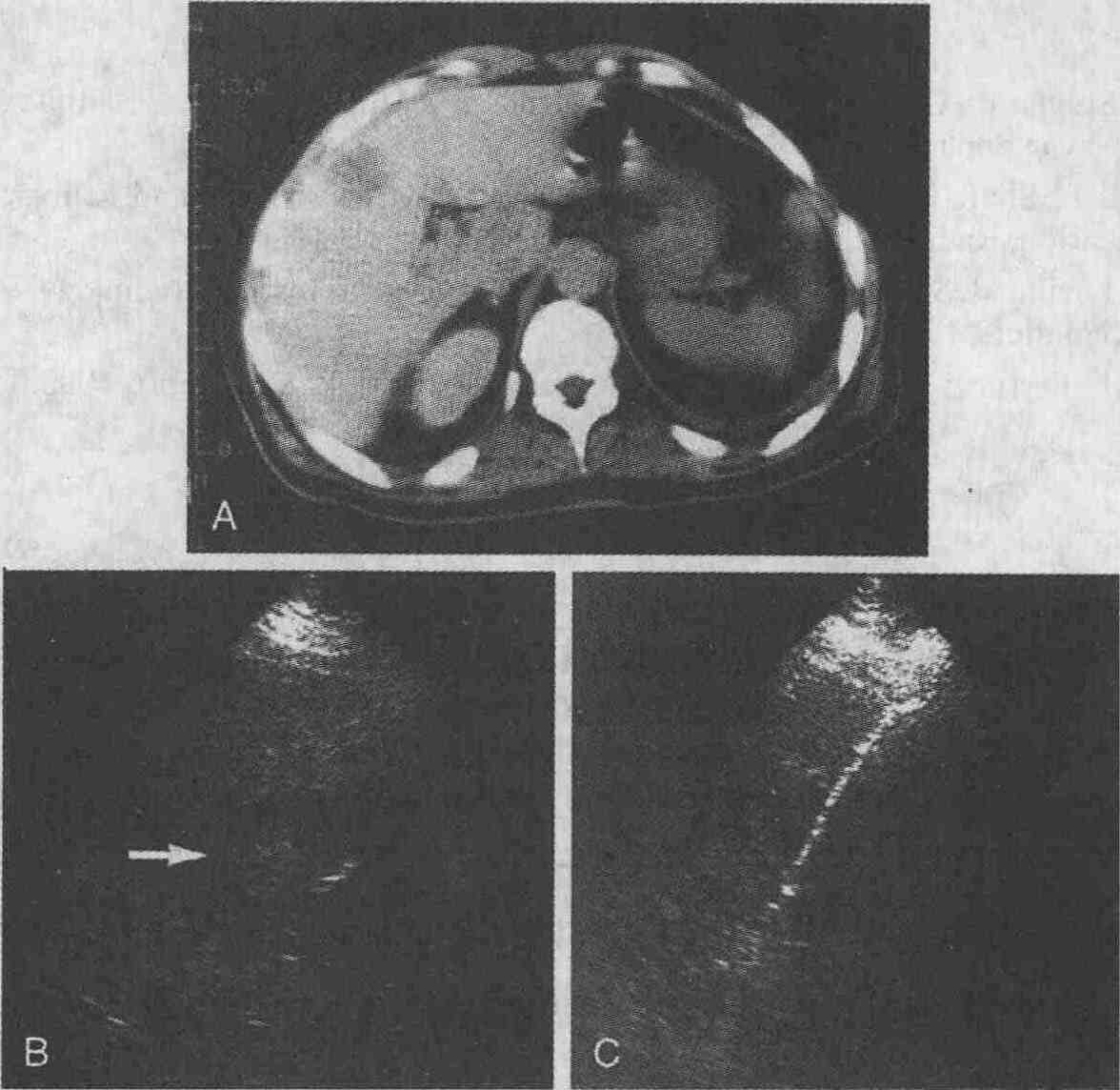
Метастазы рака ободочной кишки в печень.
А. При выполнении КТ печени с использованием контрастных веществ определяется
участокткани со сниженной плотностью диаметром 3 см. В. При УЗИ в печени
определяется объемное гипоэхогенное образование (стрелка). С. При ультразвуковом
сканировании видна биопсийная игла (снимок сделан во время выполнения биопсии,
проводимой под контролем УЗИ)
2. На основании чего производится выбор
иглы для выполнения биопсии?
В настоящее время промышленность выпускает
биопсийные иглы различных размеров — от 15-го до 23-го. Выбор иглы определенного
размера зависит от того, для какого исследования нужен материал: иглы большого
диаметра используются для забора образцов ткани для гистологического исследования
(так называемая биопсия толстой иглой), а иглы маленького диаметра — для
забора образцов ткани для цитологического исследования (так называемая
биопсия тонкой иглой). Биопсия толстой иглой выполняется иглами
16-20-го размеров, снабженными специальными механизмами с пружинками. При
этом обычно получают образец ткани, анализ которого позволяет поставить
специфический гистологический диагноз. Биопсию толстой иглой следует выполнять
пациентам, у которых неизвестна локализация первичной опухоли. Иглы 15-го
размера применяются при наличии клинических признаков лимфомы, так как
в этом случае только биопсия толстой иглой позволяет произвести забор необходимого
количества ткани и произвести гистологическую верификацию диагноза. Для
проведения биопсии тонкой иглой используются иглы небольшого диаметра (21-23-й
номер), с помощью которых можно производить забор тканей из подозрительных
участков для цитологического исследования. Злокачественный характер патологического
образования, как правило, можно определить при цитологическом исследовании,
хотя нередко бывает довольно сложно выполнить цитологическую верификацию
опухолевых клеток, что диктует необходимость изучения препаратов опытным
морфологом-цитологом. Пациентам, у которых установлена локализация первичной
опухоли и подозревается наличие метастазов, обычно бывает достаточно выполнения
биопсии тонкой иглой. Недавно проведенные исследования показали, что частота
развития осложнений при использовании тонких и толстых игл приблизительно
одинакова.
3. Каковы противопоказания к выполнению
чрескожной пункционной биопсии?
Противопоказаний к выполнению
пункционной биопсии очень немного. Прежде всего должно быть обеспечено
безопасное прохождение иглы через кожу к "тканям-мишеням". При наличии
любых нарушений свертывающей системы крови необходимо произвести их коррекцию
перед выполнением биопсии.
4. Какие осложнения могут возникнуть
при проведении пункционной биопсии?
Осложнения при выполнении пункционной биопсии
возникают сравнительно редко. Частота развития осложнений при этом варьируется
от 0,3 до 0,8 %; к наиболее часто встречающимся осложнениям относятся кровотечение,
повреждение близлежащих органов, панкреатит и нагноение раны в месте прокола.
Диссеминация опухолевых клеток в результате выполнения биопсии происходит
редко.
5. Какие визуализирующие методы можно
использовать при обследовании пациентов с подозрением на наличие абсцессов
брюшной полости?
Любой воспалительный процесс,
в который вовлекаются какие-либо органы брюшной полости, включая петли
кишки, может приводить к образованию внутрибрюшинных абсцессов. Предпочтительным
визуализирующим методом при обследовании пациентов с предполагаемым внутрибрюшинным
абсцессом является компьютерная томография органов брюшной полости и таза
(см. рисунок). Ультразвуковое сканирование чаще всего применяется в качестве
скринингового метода для выявления абсцессов в брюшной полости, хотя УЗИ
также может быть полезно при обследовании тяжелых больных, находящихся
в отделении интенсивной терапии.
Внутрибрюшинные абсцессы
Абсцессы при болезни Крона
Абсцессы при дивертикулите толстой
кишки
Периаппендикулярные абсцессы
Абсцессы печени
Абсцессы почек и паранефральной клетчатки
Абсцессы поджелудочной железы
Абсцессы селезенки
Воспалителные заболевания органов
малого таза/абсцессы малого таза
Послеоперационные абсцессы брюшной
полости
6. Можно ли вылечить с
помощью чрескожного дренирования абсцесс, полость которого сообщается с
просветом кишки?
Как консервативное, так и
оперативное лечение кишечных свищей представляет собой очень сложную проблему.
Основными элементами лечения являются обеспечение неподвижности кишки,
парентеральное питание, а также адекватное дренирование абсцесса и декомпрессия
свищевого хода. Чрескожное дренирование таких абсцессов связано с меньшим
риском развития осложнений и с меньшей вероятностью летального исхода,
чем классические хирургические вмешательства. Установление дренажной трубки
в свищевом ходе обеспечивает декомпрессию абсцесса и создает условия для
закрытия свища в дальнейшем. В случае обильного выделения содержимого абсцесса
может потребоваться дренирование этого абсцесса в течение нескольких месяцев.
7. Как часто удается успешно
производить чрескожное дренирование абсцессов?
Внутрибрюшинные абсцессы
излечиваются при применении техники чрескожного дренирования более чем
у 80 % пациентов. У 5-10 % пациентов чрескожное дренирование абсцессов
с успехом используется в качестве временной меры, позволяющей стабилизировать
состояние пациентов перед выполнением хирургического вмешательства (например,
при перфорации червеобразного отростка или при дивертикулите). Отсутствие
эффекта от чрескожного дренирования абсцессов или развитие рецидивов после
лечения наблюдаются менее чем у 5 % пациентов.
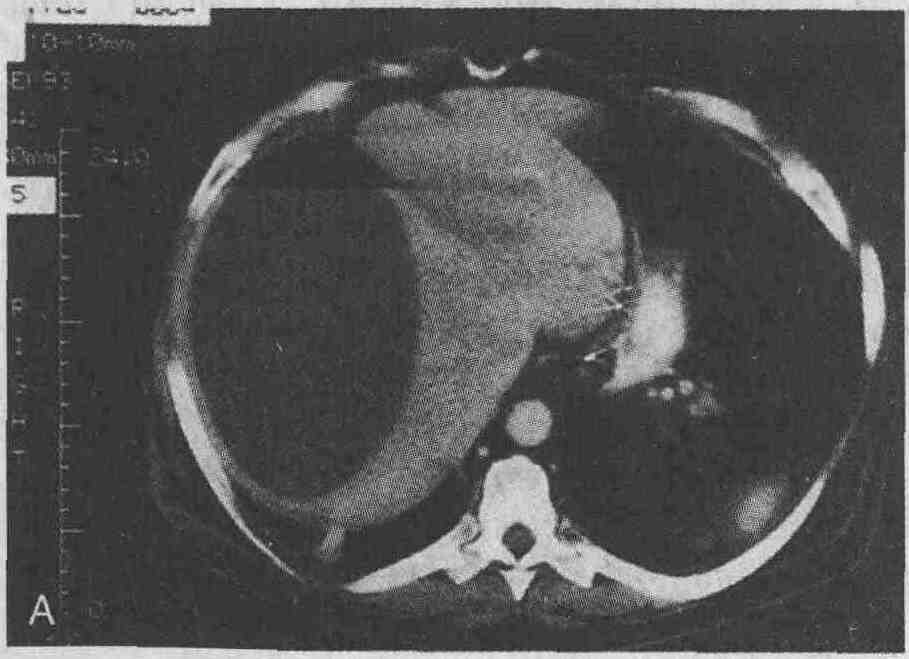
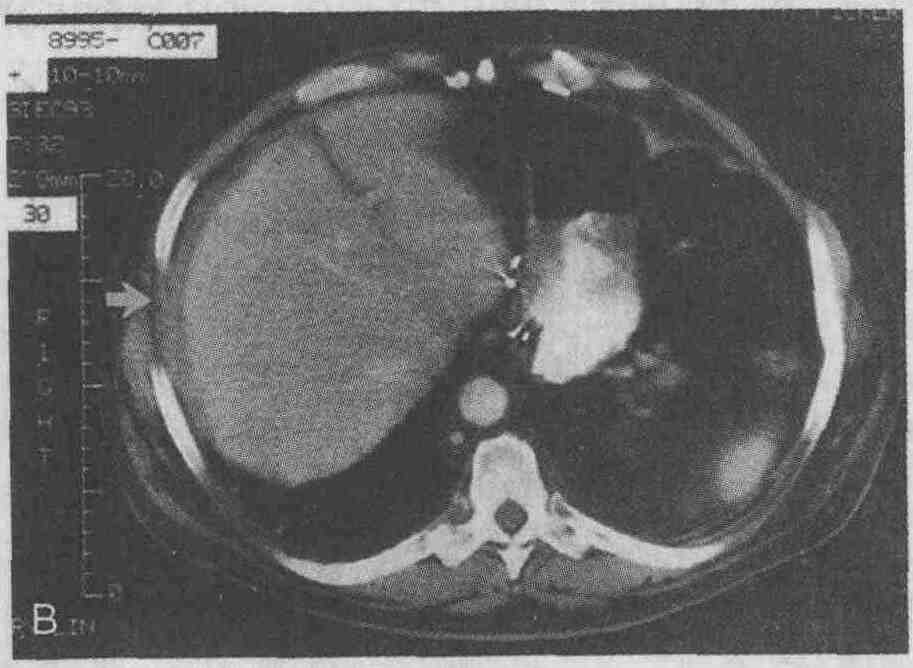
Мужчина, 65 лет, через 6 мес после
устранения вентральной грыжи и холецистэктомии стал жаловаться на лихорадку
и общее недомогание. А. При проведении КТ был обнаружен поддиафрагмальный
абсцесс справа больших размеров. В. Через некоторое время при проведении
КТ было выявлено только минимальное утолщение участка диафрагмы, прилежащего
к капсуле печени (стрелка)
8. Каким пациентам не
следует выполнять чрескожное дренирование абсцессов?
Единственным абсолютным противопоказанием
к выполнению чрескожного дренирования абсцесса является невозможность безопасно
провести дренажную трубку. В таких случаях пациентам показано хирургическое
вмешательство. Предпочтительным методом является внебрюшинное дренирование
абсцессов; однако иногда возможно осуществление дренирования через плотные
органы (печень) или через желудок. Перед дренированием любого абсцесса
целесообразно назначить пациенту курс лечения антибиотиками широкого спектра
действия, что снизит риск развития септического шока во время выполнения
процедуры.
9. Каковы критерии эффективности
консервативного лечения абсцессов?
Критериями эффективности
лечения абсцессов брюшной полости с помощью их чрескожного дренирования
являются исчезновение лихорадки, снижение лейкоцитоза, уменьшение недомогания
и ослабление других общих симптомов. Лечение считается эффективным тогда,
когда улучшается общее самочувствие пациента, при ультразвуковом или компьютерном
сканировании определяется полное исчезновение абсцесса, а количество свищевого
отделяемого, оттекающего по дренажной трубке, составляет не более 10 мл/день.
10. Можно ли проводить
лечение абсцессов печени методом чрескожного дренирования?
Да. Современное лечение внутрипеченочных
абсцессов включает в себя их чрескожное дренирование, проводящееся на фоне
внутривенного введения антибиотиков, целенаправленно воздействующих на
микроорганизм-возбудитель. Лечение пиогенных и амебных абсцессов печени
с помощью чрескожного дренирования эффективно более чем в 95 % случаев.
Относительным противопоказанием к выполнению чрескожного дренирования является
наличие внутрипеченочных эхинококковых кист, так как попадание их содержимого
в брюшную полость вызывает развитие тяжелых анафилактических реакций. Критерии
эффективности лечения внутрипеченочных абсцессов такие же, как и критерии
эффективности лечения внутрибрюшинных абсцессов.
11. Какие методы используются для диагностики
панкреатита?
Стандартным методом диагностики и определения
степени тяжести острого панкреатита является динамическая компьютерная
томография с использованием контрастных препаратов. Первичное проведение
компьютерной томографии показано следующим пациентам:
1) пациентам, у которых клинический диагноз
острого панкреатита вызывает сомнения;
2) пациентам с тяжелым клиническим течением
острого панкреатита;
3) пациентам, у которых сумма баллов по
шкале Рэнсона (Ranson) составляет более 3 или по шкале APACHE — более 8;
4) пациентам, у которых состояние не улучшилось
в результате проведения консервативной терапии в течение 72 ч;
5) пациентам, состояние которых после
некоторого улучшения, наблюдавшегося на начальном этапе проведения медикаментозной
терапии, быстро ухудшилось. УЗИ является дополнительным методом, применяющимся
при обследовании пациентов с панкреатитом. Этот метод наиболее целесообразно
использовать для динамического контроля за накоплением жидкости в поджелудочной
железе и парапанкреа-тической клетчатке. Роль магнитно-резонансной томографии
в постановке диагноза и определении степени тяжести острого панкреатита
в настоящее время еще полностью не уяснена.
12. Каковы осложнения острого панкреатита?
При проникновении секрета поджелудочной
железы в ее паренхиму и в парапанкреатическую клетчатку развиваются многочисленные
осложнения, к которым относятся некроз поджелудочной железы (асептический
или имеющий инфекционную природу), скопление жидкости в паренхиме поджелудочной
железы или в парапанк-реатической клетчатке (ложные кисты или абсцессы)
и кровотечение. Некроз поджелудочной железы выявляется при проведении
динамической КТ с использованием контрастных веществ. Очаги некроза имеют
вид участков с пониженной плотностью по сравнению с неизмененной паренхимой
поджелудочной железы. Абсцесс поджелудочной железы образуется быстро,
тогда как ложная киста обычно формируется в течение 4-8 нед с момента появления
симптомов острого панкреатита. Кровотечения могут возникать как на ранних,
так и на поздних стадиях развития панкреатита, причем поздние кровотечения
в забрюшинную клетчатку нередко угрожают жизни пациента. Разрывы ложных
аневризм, обычно селезеночной или верхней брыжеечной артерий, приводят
к внезапному возникновению массивных кровотечений, которые диагностируются
при проведении КТ по скоплениям жидкости в брюшной полости, забрюшинном
пространстве или по увеличению объема уже имеющихся скоплений жидкости.
Методом выбора при внезапном возникновении кровотечения является экстренная
ангиография с последующей эмболизацией соответствующего сосуда.
13. Можно ли использовать КТ для определения
степени тяжести панкреатита?
На основании данных КТ врачи
разработали классификационную систему, которая отражает степень тяжести
острого панкреатита. КТ позволяет установить наличие и выраженность воспаления
парапанкреатической клетчатки и/или застоя жидкости, а также наличие и
распространенность некроза поджелудочной железы. На основании комбинации
двух выявляемых при КТ прогностических факторов (скопления жидкости и некроза
железы) устанавливается КТ-индекс степени тяжести острого панкреатита,
варьирующийся от 1 до 10. Результаты проведенных исследований свидетельствуют
о том, что не более 5 % пациентов с КТ-индексом, равным 0-2, нуждаются
в интенсивном стационарном лечении и летальность среди этих пациентов составляет
0 %, в то время как пациентам с КТ-индексом, равным 7-10, интенсивное лечение
необходимо в 90 % случаев, а летальность средит этих пациентов достигает
15-25 %.
КТ-индекс степени тяжести острого
панкреатита

14. Как часто лечение
ложных кист поджелудочной железы посредством их чрес-кожного дренирования
оказывается эффективным?
Лечение неинфицированных
ложных кист поджелудочной железы посредством их дренирования дает эффект
более чем в 90 % случаев. Эффективность хирургического лечения ложных кист
приблизительно такая же. Однако процедура чрескожного дренирования ложных
кист поджелудочной железы менее болезненна. Для достижения большего эффекта
от лечения катетер не следует удалять до тех пор, пока не закроется сообщение
с протоком поджелудочной железы и не спадется полость кисты.
15. В каких случаях показано
чрескожное дренирование ложных кист поджелудочной железы?
При скоплении небольших количеств
жидкости в области поджелудочной железы обычно нет необходимости в произведении
чрескожного дренирования. Более чем в 50 % случаев скопления жидкости,
внезапно образующиеся вследствие острого панкреатита (включая ложные кисты
поджелудочной железы диаметром менее 5 см), претерпевают спонтанное обратное
развитие и поэтому их можно лечить консервативно. Однако при увеличении
размеров кисты, вызывающем развитие болевого синдрома, при инфицировании
содержимого кисты, а также при обструкции желчных протоков или желудочно-кишечного
тракта показано дренирование кисты (рисунок). Единственным исключением
из этого правила являются ложные кисты поджелудочной железы, образующиеся
в результате панкреонекроза. Так как при произведении чрескожного дренирования
существует большой риск бактериального инфицирова-ния, методом выбора при
панкреонекрозе является хирургическое вскрытие кисты и удаление некротических
тканей.
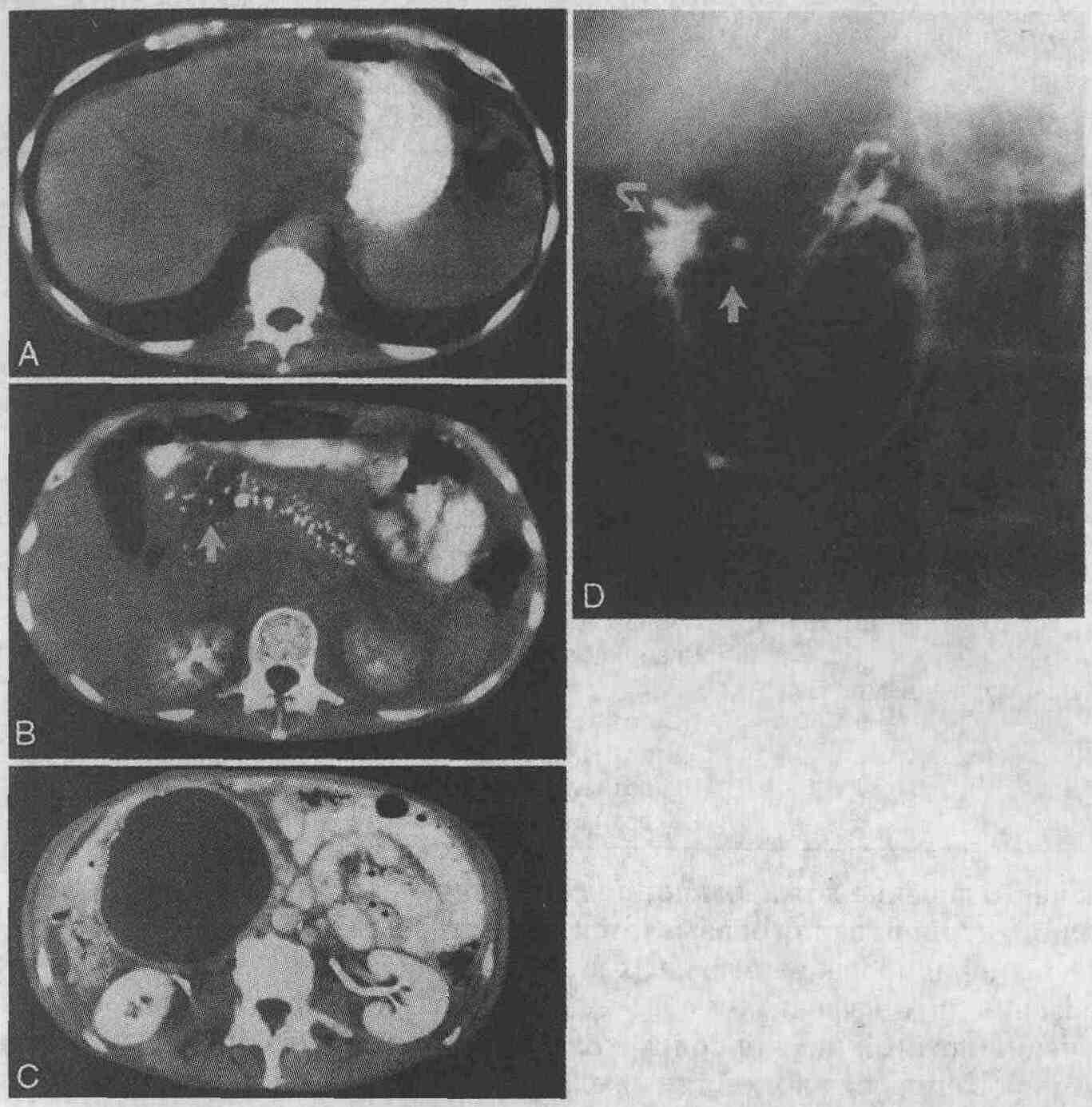
У 64-летнего мужчины с хроническим
панкреатитом в анамнезе имеются симптомы желтухи, а в правых отделах брюшной
полости пальпируется опухолевидное образование. А. На КТ определяется расширение
внутрипеченочных желчных протоков. В. Видны ложные кисты в области головки
поджелудочной железы (стрелка) и кальциноз ткани железы, развившийся в
результате хронического панкреатита. С. Книзу от головки поджелудочной
железы определяется ложная киста большого размера. D. При выполнении фистулографии
обнаружено сообщение ложной кисты с панкреатическим протоком (стрелка)
и двенадцатиперстной кишкой (изогнутая стрелка)
16. Какова роль рентгенологических
исследований в лечении абсцессов поджелудочной железы посредством инвазивных
методов?
Абсцессы поджелудочной железы
можно эффективно лечить посредством их чрескожного дренирования. Эффективность
дренирования зависит от размера используемых катетеров (20-24 F) и контейнеров
для сбора отделяемого. Традиционные хирургические методы лечения абсцессов
поджелудочной железы характеризуются высокой летальностью, которая варьируется
от 14 до 56 %. Если изначально была сделана попытка чрескожного дренирования
абсцесса поджелудочной железы, то это не помешает в дальнейшем при необходимости
произвести хирургическое вмешательство.
17. Назовите метод выбора
для лечения инфицированных некрозов поджелудочной железы.
Прежде всего крайне важно
отдифференцировать абсцесс поджелудочной железы от инфицированного некроза
поджелудочной железы. Частота летальных исходов при инфицированных некрозах
поджелудочной железы почти в 2 раза выше, чем при абсцессах поджелудочной
железы. Методом выбора в данном случае является хирургическая некросеквестрэктомия
и широкое дренирование поджелудочной железы. Целесообразность применения
чрескожного дренирования в данном случае является по меньшей мере спорной.
Через катетер можно удалить лишь ограниченное количество некротизированных
тканей, полное удаление которых является непременным условием эффективного
лечения.
18. Что такое химиоэмболизация
печеночных сосудов?
Химиоэмболизация печеночных
сосудов (ХЭП) представляет собой один из методов местного лечения злокачественных
поражений печени. Основным показанием к ХЭП является наличие у пациента
неоперабельной опухоли печени. Суть данной процедуры заключается во внутриартериальном
введении химиотерапевтических препаратов и эмболизации сосудов, кровоснабжающих
опухоль, что приводит к созданию высокой местной концентрации химиопрепаратов
и ишемии опухоли, а также к уменьшению системного токсического эффекта.
ХЭП является относительно
безопасным и эффективным методом лечения, так как к опухолям печени кровь
поступает из печеночной артерии. Уникальное двойное кровоснабжение печени
(за счет печеночной артерии и воротной вены) позволяет выполнять безопасную
эмболизацию печеночной артерии с небольшим риском развития ишемии печени.
19. Почему химиоэмболизацию
печеночных сосудов следует использовать для лечения пациентов со злокачественными
новообразованиями печени?
Методом выбора при лечении
пациентов со злокачественными новообразованиями печени является оперативное
лечение. К сожалению, большинству таких пациентов проведение хирургического
вмешательства противопоказано из-за значительного распространения опухоли,
поражения кровеносных сосудов, сопутствующего нарушения функции печени
или наличия отдаленных метастазов. Эффект от использования других традиционных
методов лечения, таких как системная химиотерапия и лучевая терапия, у
пациентов со злокачественными новообразованиями печени очень незначителен.
20. Какова эффективность
химиоэмболизации печеночных сосудов?
Эффективность ХЭП при лечении
пациентов с печеночноклеточной карциномой, метастазами карциноида и опухолей
островковых клеток поджелудочной железы довольно высока, однако при наличии
опухолей толстой кишки эффективность химиоэмболизации печеночных сосудов
значительно ниже. Этот метод лечения является паллиативным, он позволяет
на какое-то время устранить симптомы заболевания, однако не увеличивает
продолжительность жизни пациентов.
21. Является ли чрескожное
чреспеченочное дренирование желчевыводящих путей основным методом лечения
пациентов с закупоркой желчных протоков?
Роль чрескожного чреспеченочного
дренирования желчных протоков в лечении пациентов с доброкачественными
и злокачественными заболеваниями желчевыводящей системы существенно уменьшилась
после введения в клиническую практику лечебной эндоскопии. В настоящее
время методом выбора при необходимости выполнения декомпрессии желчевыводящей
системы является эндоскопическое дренирование желчных протоков, так
как оно сопровождается меньшим риском развития осложнений по сравнению
с чреспеченочным дренированием и лучше переносится пациентами. Однако в
тех случаях, когда эндоскопическое дренирование желчных протоков выполнить
не удается, чрескожное чреспеченочное дренирование желчных протоков по-прежнему
играет определенную роль. В нашем институте лечение заболеваний желчевыводящей
системы проводится коллективом врачей, состоящим из эндоскописта, рентгенолога
и хирурга. Всем пациентам, которым не удается выполнить эндоскопическое
дренирование желчных протоков, выполняется чрескожное чреспеченочное дренирование
желчных протоков.
22. Каковы показания к
выполнению чрескожного чреспеченочного дренирования желчных протоков?
• Невозможность выполнения
эндоскопического дренирования желчных протоков.
• Окклюзия желчных протоков
на уровне ворот печени.
• Нарушение проходимости
ранее наложенного билиодигестивного анастомоза.
• Повреждение желчных протоков
при выполнении лапароскопической холецистэктомии.
Наиболее часто встречающимся
показанием к выполнению чрескожного чреспеченочного дренирования желчных
протоков является невозможность по какой-либо причине выполнить эндоскопическое
дренирование.
Ликвидация окклюзии желчных
протоков на уровне ворот печени представляет собой довольно сложную
проблему при выполнении каких-либо эндоскопических вмешательств. Обструкция
желчных протоков на этом уровне обычно развивается вторично при холангиокарциноме
или при метастатическом поражении, вовлекающем правый и левый печеночные
протоки, с частой окклюзией внутрипеченочных сегмен-тарных протоков. Мультисегментарная
природа окклюзии желчных протоков при такой патологии затрудняет эндоскопическое
дренирование, поэтому в большинстве случаев дренирование желчных протоков
предпочтительнее выполнять с помощью чрескожной чреспеченочной методики.
Частота эффективного выполнения
эндоскопического дренирования желчных протоков у пациентов с нарушением
проходимости ранее наложенного билиодигестивного анастомоза составляет
не более 50 %. Это связано с техническими сложностями при проведении эндоскопа
через приводящую петлю кишки. Таким пациентам для выявления рецидивов заболевания
и стриктуры анастомоза необходимо выполнять чрескожное чреспеченочное дренирование
желчных протоков.
Повреждение желчных протоков,
возникающее
при выполнении лапароскопической холецистэктомии, обусловлено случайными
разрывами или небрежным дотированием желчных протоков. Чрескожное чреспеченочное
дренирование желчных протоков выполняется с целью ликвидации препятствия
току желчи или при подтека-нии желчи в брюшную полость, для произведения
декомпрессии, отведения желчи и установки стента в области повреждения.
Эти мероприятия позволяют обойтись без дополнительного оперативного вмешательства.
Проведенное перед плановым оперативным вмешательством чрескожное чреспеченочное
дренирование желчных протоков способствует стабилизации состояния пациента.
Эндоскопическое дренирование таким пациентам производить крайне сложно,
поскольку повреждение желчных протоков у них может быть очень сильно выраженным.
23. Каковы преимущества
и недостатки использования металлических стентов для лечения обструкции
желчных путей?
Металлические стенты постепенно
вытеснили из употребления пластиковые эндопро-тезы, применявшиеся ранее
при чрескожном лечении закупорки желчных путей злокачественными опухолями
(см. рисунок). Основным преимуществом металлических стентов является возможность
применения для их установки катетера гораздо меньшего диаметра, чем диаметр
пластикового эндопротеза, что позволяет уменьшить неудобства, доставляемые
пациенту, и снизить частоту развития печеночных осложнений. Кроме того,
у металлических стентов больше внутренний диаметр (ширина просвета равна
1см), что способствует более эффективному дренированию желчных протоков
и дает возможность использовать эти стенты в течение длительного времени.
Недостатком металлических стентов является их высокая стоимость. В случае
их закупорки (вследствие избыточного роста опухоли, гиперплазии эпителия
или сгущения желчи) возникает необходимость в проведении повторного дренирования
желчных протоков.
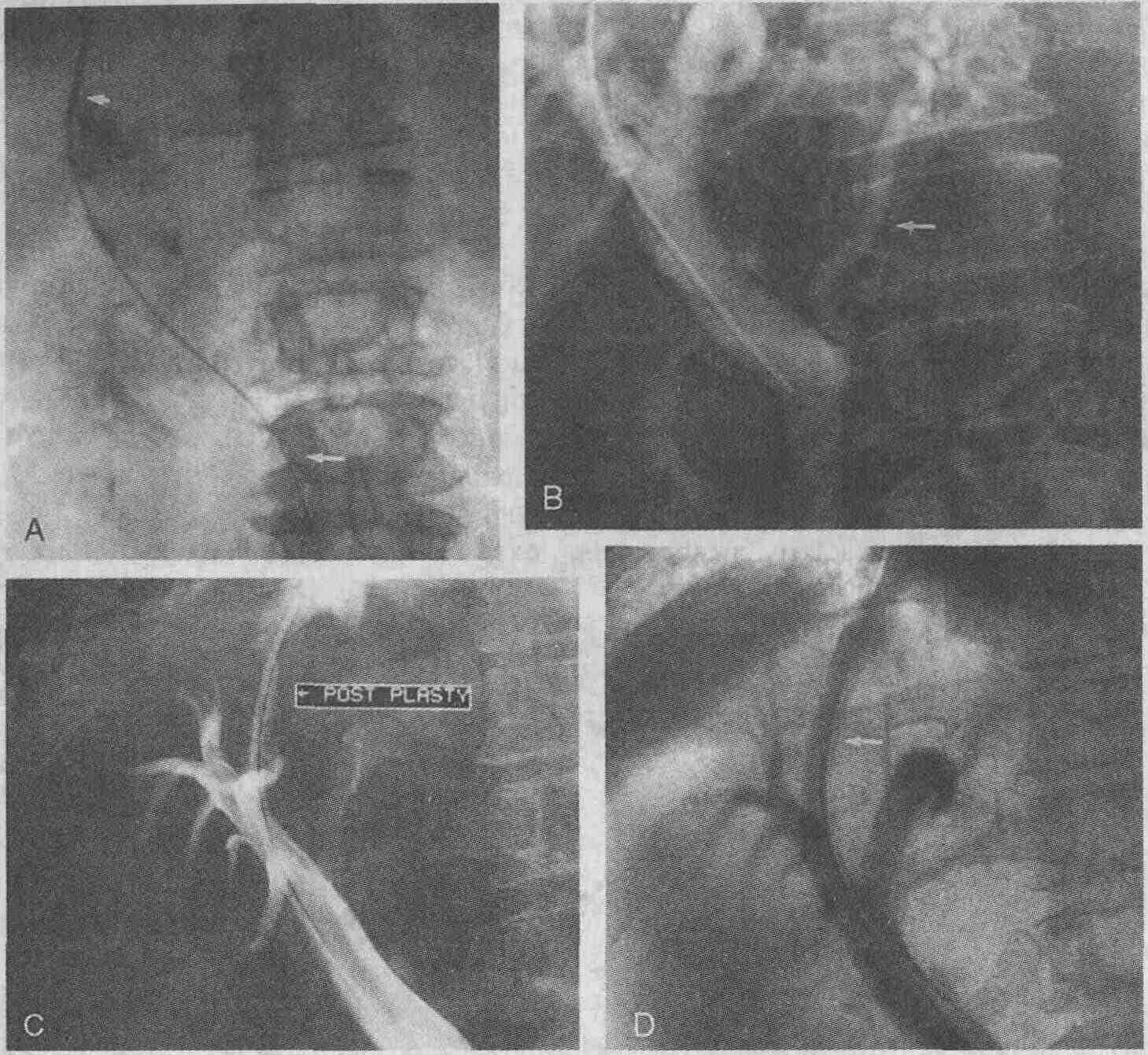
У 58-летней женщины диагностируются
желтуха и опухолевидное образование в брюшной полости. А. При проведении
чрескожного чреспеченочного дренирования желчных протоков выявлена полная
обструкция общего желчного протока. В. Установлен металлический стент,
общий желчный проток дренируется хорошо. С. При проведении КТ брюшной полости
выявлена низкодифференцированная лимфома больших размеров, окружающая стент,
установленный в общем желчном протоке (стент показан стрелкой)
24. Каковы показания к
выполнению чрескожной холецистостомии?
Чрескожное введение дренажной
трубки в полость желчного пузыря является достаточно распространенной методикой.
Существует два основных показания к выполнению чрескожной холецистостомии:
(1) резистентный к терапии сепсис неясного генеза у пациентов, страдающих
бескаменным холециститом, которые находятся в крайне тяжелом состоянии
в отделении интенсивной терапии и (2) острый холецистит у пациентов, общее
состояние которых не позволяет произвести обычное хирургическое вмешательство.
Реже чрескожная холецистостомия выполняется с целью временной декомпрессии
желчного пузыря при его перфорации, дренирования желчевыводящих путей при
наличии протяженной обструкции их злокачественными новообразованиями, а
также при проведении чреспузырных вмешательств на желчевыводящей системе.
25. Какова классификация
повреждений желчных протоков, возникающих при выполнении лапароскопической
холецистэктомии?
Класс I Повреждение общего
печеночного протока Класс II Развитие стриктур/перевязка протока Класс
III Иссечение сегмента желчного протока Класс IV Повреждение правого печеночного
протока
При выполнении лапароскопической
холецистэктомии желчные протоки обычно повреждаются на уровне проксимального
отдела общего печеночного протока в тех случаях, когда общий печеночный
проток ошибочно принимают за пузырный проток (повреждения I, III классов)
или же желчные протоки повреждаются при попытках остановить возникшее кровотечение
(повреждения II класса). Повреждения IV класса возникают, как правило,
при выполнении лапароскопической препаровки тканей в области ложа желчного
пузыря. Наиболее часто встречаются повреждения желчных протоков III класса.
Повреждения I, III и IV классов проявляются в виде желчного асцита (в России
используют термин "желчный перитонит",— прим, ред.) или биломы,
а повреждения II класса — появлением симптомов желтухи. К моменту обнаружения
этих клинических проявлений желчь в брюшной полости у пациента может уже
инфицироваться.
26. В каких случаях при
лечении пациентов с желудочно-кишечными кровотечениями выполняются диагностическая
и лечебная ангиография?
При наличии у пациентов желудочно-кишечного
кровотечения, которое не поддается консервативному или эндоскопическому
лечению, требуется проведение диагностического ангиографического исследования.
Установление источника кровотечения возможно при следующих условиях:
1. На момент проведения
исследования кровотечение у пациента должно продолжаться.
2. Кровотечение должно быть
достаточно сильным, чтобы его можно было увидеть на ангиограммах (скорость
его должна быть 1,5-2,0 мл/мин). Менее интенсивные желудочно-кишечные кровотечения
довольно сложно обнаружить с помощью ангиографии.
27. Нужно ли рентгенологу,
выполняющему ангиографию, знать о возможной локализации источника кровотечения
до проведения исследования?
Получение информации о предположительной
локализации источника желудочно-кишечного кровотечения перед выполнением
ангиографии чрезвычайно полезно. Висцеральные ангиограммы отражают состояние
слепокишечной, верхней и нижней брыжеечных артерий; для того чтобы выявить
источник кровотечения, необходимы селективная катетеризация этих сосудов,
введение в них контрастного вещества и выполнение большого количества снимков,
что занимает много времени и делает процедуру утомительной. Если при проведении
перед ангиографией эндоскопического исследования удалось установить локализацию
источника кровотечения, в первую очередь исследуются сосуды, осуществляющие
кровоснабжение данной области, при этом процедура значительно укорачивается.
Если не удается точно установить локализацию источника кровотечения, следует
по крайней мере выяснить, в каких отделах желудочно-кишечного тракта —
верхних или нижних — находится этот источник и указать рентгенологу, который
будет выполнять ангиографию, какие сосуды он должен исследовать в первую
очередь. Введение в кровь меченных изотопом 99mТс эритроцитов с последующим
сканированием также позволяет в таких ситуациях получить необходимую информацию
о локализации источника кровотечения.
28. Назовите два вида
лечебной ангиографии, применяемые для остановки желудочно-кишечных кровотечений.
Лечебная ангиография включает
в себя введение лекарственных средств и эмболизи-рующих веществ. Фармакологическим
препаратом выбора является вазопрессин (питрессин). Этот гормон гипоталамуса
оказывает прямое воздействие на гладкую мускулатуру артериол и капилляров,
вызывая их спазм. Верхняя брыжеечная, желудочно-двенадцатиперстная, левая
желудочная и желудочно-сальниковая артерии особенно чувствительны к этому
внутриартериально введенному препарату. После выполнения селективной катетеризации
кровоточащего сосуда в его просвет вводится вазопрессин со скоростью 0,2
ЕД/мин (см. рисунок). Чтобы оценить эффективность терапии, через 30 мин
проводится повторное ангиографическое исследование. Если кровотечение продолжается,
скорость введения вазопрессина может быть увеличена до 0,4 ЕД/мин. Препарат
вводится в течение 12-24 ч. В течение этого времени необходимо проводить
тщательное мониторирование жизненно важных функций пациента, чтобы не пропустить
момента возникновения каких-либо побочных эффектов, при развитии которых
лечение должно быть остановлено (ишемия миокарда, кишки, конечностей; задержка
жидкости в организме; гипонатриемия; нарушения сердечного ритма). Должны
периодически проводиться контрольные исследования, как клинические, так
и ангиографические. Если кровотечение остановлено, дозу вводимого вазопрессина
постепенно уменьшают и в конце концов переходят к введению изотонического
раствора натрия хлорида, после чего катетер удаляют.
Лечение желудочно-кишечных
кровотечений можно также проводить посредством эмболизации кровеносных
сосудов. Для этого катетер подводят к месту кровотечения и через его просвет
вводят эмболизирующее вещество. Эмболизирующие препараты могут давать постоянный
или временный эффект. К препаратам, дающим временный эффект, относятся
гелфоам (Gelfoam) и аутологичные тромбы. Эмболи-зирующих препаратов, дающих
постоянный эффект, существует гораздо больше. Это поливиниловый спирт,
различные спирали, клеи и этиловый спирт. Из перечисленных препаратов для
остановки желудочно-кишечных кровотечений, как правило, применяют Gelfoam
и различные клеи. Разработанные в последние годы специальные направляющие
системы и микрокатетеры дают возможность выполнять суперселективную катетеризацию
и подводить эмболизирующий препарат точно к источнику кровотечения. Эти
современные изобретения позволяют снизить риск развития инфарктов кишки
и делают ангиографию относительно безопасной процедурой даже в случаях
кровотечений из тонкой или ободочной кишки.
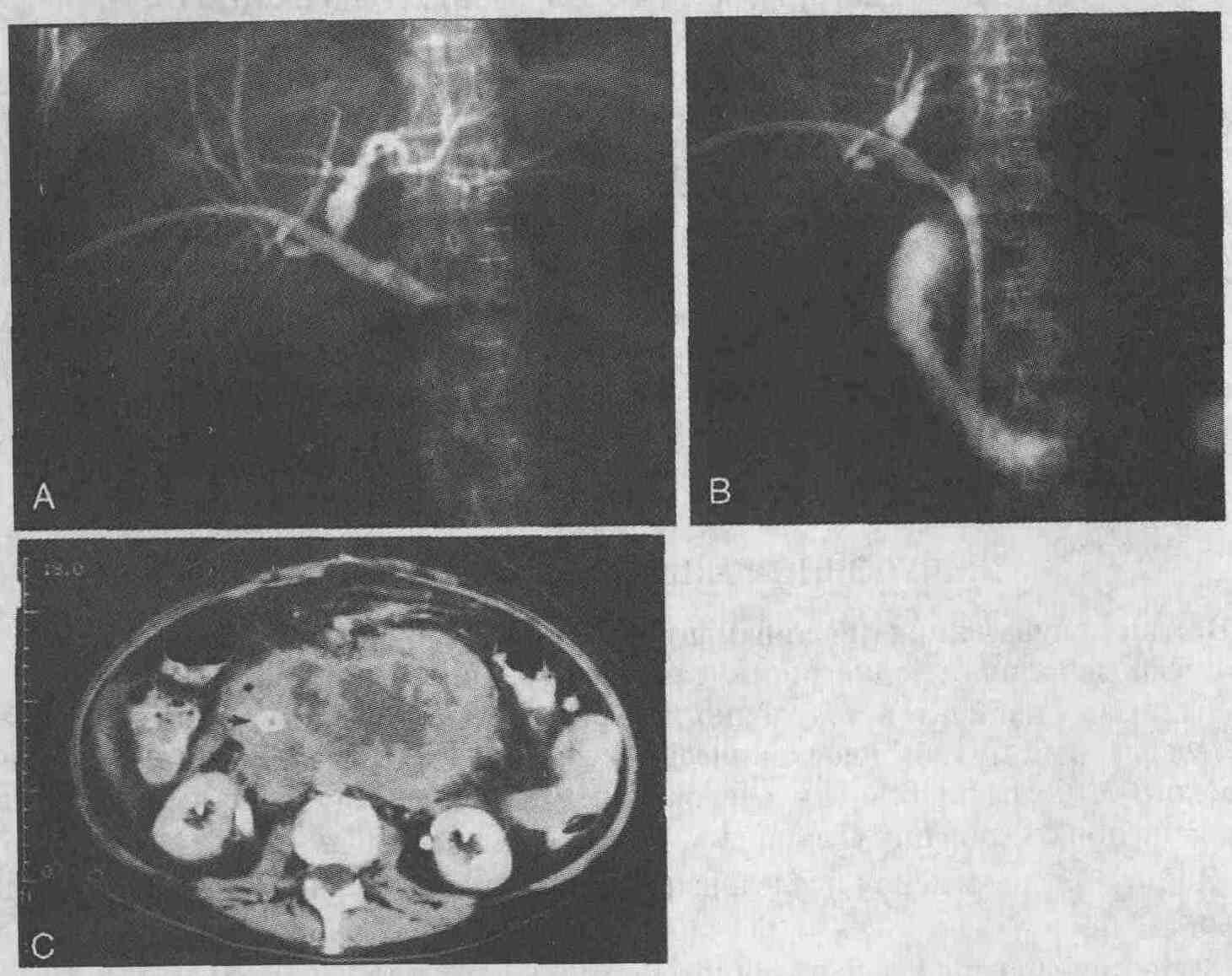
У 60-летнего мужчины возникло кровотечение
из нижних отделов желудочно-кишечного тракта. А. Была проведена диагностическая
ангиография с селективным контрастированием верхней брыжеечной артерии.
На ангиограммах признаки кровотечения отсутствуют. В. На полученных через
некоторое время ангиограммах видны затеки рентгеноконтрастного вещества
в проксимальной части левых отделов ободочной кишки; у пациента выявлено
кровотечение из дивертикула (стрелка). С. После введения вазопрессина в
течение 30 мин со скоростью 0,2 ЕД/мин кровотечение было остановлено. Обратите
внимание на то, что верхняя брыжеечная артерия и ее ветви спазмированы
29. Что такое трансяремное
внутрипеченочное портокавальное шунтирование? Как оно выполняется?
Трансяремное внутрипеченочное портокавальное
шунтирование представляет собой метод, позволяющий с помощью чрескожной
пункции яремной вены создавать в печени шунт между воротной и печеночной
венами. Этот метод применяется для остановки кровотечений из варикозно
расширенных вен пищевода и желудка, возникающих при портальной гипертензии
(см. рисунок). Доступ в центральную венозную систему осуществляется через
правую внутреннюю яремную вену. Для выполнения ТВПШ предпочтительнее выбирать
правую печеночную вену, хотя можно также использовать и среднюю печеночную
вену. Для создания чреспеченочно-го шунта между печеночной и воротной веной
применяется трансяремная игла Ко-лапинто (Colapinto) 16-го размера. Чреспеченочный
шунт затем расширяется с помощью баллонного катетера, после чего устанавливается
гибкий металлический стент.
Успешное выполнение ТВПШ приводит к снижению
градиента портокавального давления до 8-12 мм рт. ст. Диаметр стента увеличивают
до тех пор, пока этот уровень не будет достигнут. Портокавальный градиент
давления является важным показателем, величина которого тесно связана со
степенью выраженности портальной гипертензии. Кровотечения из варикозно
расширенных вен редко возникают у пациентов, у которых портокавальный градиент
давления менее 12 мм рт. ст. Посредством ТВПШ обычно достигается декомпрессия
варикозно расширенных вен пищевода. Если же при проведении портальной флебографии
выясняется, что варикозно расширенные вены пищевода продолжают наполняться,
показано проведение селективной эмболизации этих сосудов.
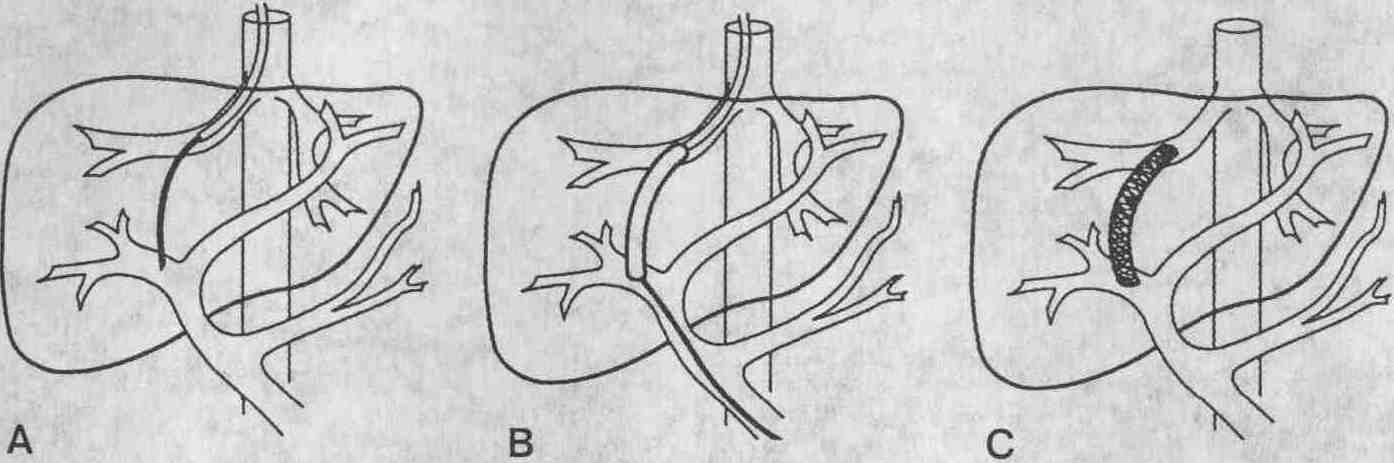
Схема выполнения ТВПШ. А. Через правую
печеночную вену подводится катетер, затем с помощью иглы Колапинто выполняют
пункцию воротной вены внутри печени. В. Паренхиму печени в месте прокола
раздвигают с помощью баллонного катетера. С. По ходу чреспеченочного шунта
устанавливают гибкий металлический стент, соединяющий печеночную и воротную
вены
30. Каковы показания к
ТВПШ?
Основным показанием к ТВПШ является не
поддающееся консервативной терапии кровотечение из варикозно расширенных
вен пищевода и желудка (см. рис. 7). Кровотечения подразделяются на
острые (продолжающиеся сильные кровотечения, которые не удается остановить
с помощью склеротерапии или фармакотерапии) и хронические (рецидивирующие
сильные кровотечения, возникающие несмотря на проводимую склеротерапию).
В то же время не рекомендуется начинать с ТВПШ лечение пациентов с кровотечениями
из варикозно расширенных вен, предотвращение развития рецидивов кровотечений
из варикозно расширенных вен, а также предоперационную подготовку перед
трансплантацией печени (существует ошибочное мнение, что ТВПШ снижает частоту
летальных исходов во время и после операции). Выполнение ТВПШ особенно
целесообразно при кровотечениях из недоступных варикозно расширенных вен
желудка и кишечника, а также при гастропатии, развившейся вследствие портальной
гипертензии. В настоящее время исследуются две потенциальных возможности
применения ТВПШ: асцит, не поддающийся лечению мочегонными препаратами,
и гепаторенальный синдром.
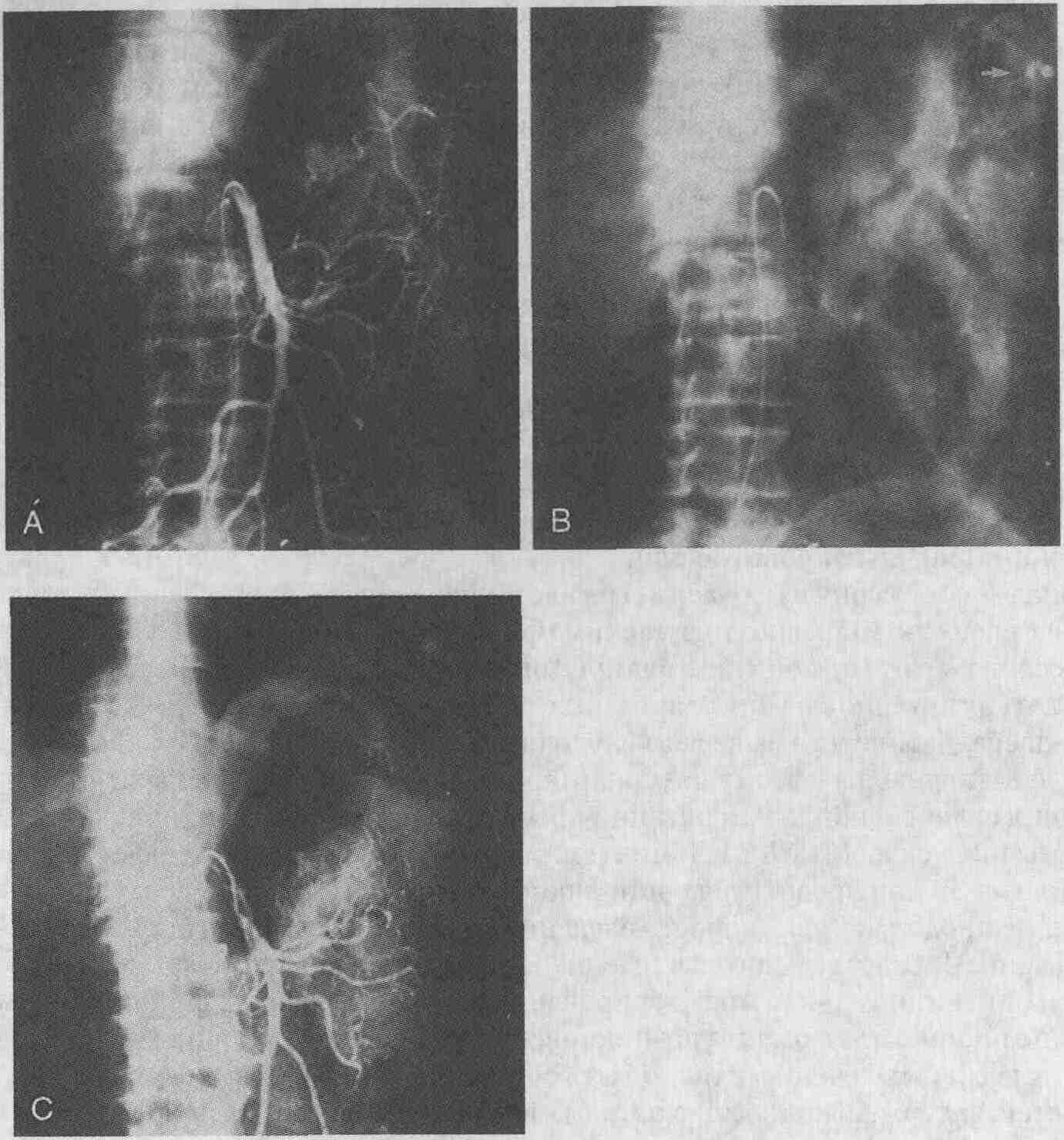
Произведение ТВПШ 52-летней женщине
с криптогенным циррозом печени и не поддающимся консервативному лечению
кровотечением из варикозно расширенных вен. А. Выполнена пункция воротной
вены с помощью иглы Колапинто (стрелка), и в верхнюю брыжеечную вену введен
проводник (стрелка). Портокавальный градиент давления (ПГД) равен 28 мм
рт.ст. В. На портальной флебограмме видны расширенные вены кардиального
отдела желудка и варикозно расширенные вены пищевода (стрелка). С. Затем
выполняется баллонная дилатация чреспеченочного шунта и формируется субоптимальный
Портокавальный шунт. D. Металлический стент (стрелка) устанавливается по
ходу чрезпеченочного шунта, что позволяет увеличить диаметр его просвета.
ПГД после выполнения шунтирования составил 10 мм рт. ст.
31. Существуют ли противопоказания к
ТВПШ?
Существует несколько абсолютных противопоказаний
к произведению ТВПШ. Эту операцию нельзя выполнять при наличии у пациентов
поликистоза печени. У таких пациентов очень высок риск возникновения кровотечений,
так как на пути создания шунтового хода могут оказаться как паренхима печени,
так и кисты. Кроме того, при выполнении ТВПШ повышается давление в правых
отделах сердца, вследствие чего эту операцию не следует производить пациентам
с правожелудочковой недостаточностью. Относительными противопоказаниями
являются системные инфекции, тромбоз воротной вены, обструкция желчных
протоков и выраженная печеночная энце-фалопатия.
32. Какова частота успешного выполнения
ТВПШ? Почему иногда эту операцию выполнить не удается?
ТВПШ является одним из наиболее сложных
инвазивных вмешательств. Несмотря на это, данная процедура успешно выполняется
более чем в 90 % случаев. Большая часть неудач при произведении ТВПШ обусловлена
вторичной окклюзией воротной вены, так как через окклюзированный участок
сосуда невозможно провести катетер из яремной вены.
33. Какова эффективность ТВПШ при остановке
кровотечений из варикозно расширенных вен пищевода и желудка?
ТВПШ является чрезвычайно
эффективным методом остановки острых кровотечений из варикозно расширенных
вен пищевода и желудка. По своей эффективности ТВПШ не уступает портокавальному
анастомозу, наложенному оперативным путем. Кроме того, ТВПШ не сопровождается
дополнительным риском нарушения функций печени, в то время как при общей
анестезии такой риск существует. Проведенные исследования показали, что
рецидивы кровотечений из варикозно-расширенных вен после выполнения ТВПШ
возникают менее чем в 10 % случаев. Почти все пациенты были обследованы
с целью выявления какой-либо патологии шунта, например его стеноза или
окклюзии. При повторном ангиографическом исследовании с ревизией шунта
(с произведением баллонной дилатации или установкой дополнительного стента)
или при выполнении повторного ТВПШ удавалось остановить кровотечение почти
во всех случаях.
34. Каковы частота развития осложнений
и летальность при выполнении ТВПШ?
ТВПШ характеризуется меньшей
частотой развития осложнений и более низкой летальностью, чем портокавальные
анастомозы, наложенные хирургическим путем. Результаты обработки данных,
полученных в ходе исследования четырех самых больших из описанных в литературе
групп пациентов с ТВПШ, свидетельствуют о том, что 30-суточная летальность
составляет 7-12 %. Наибольшее количество летальных исходов имеет место
у пациентов класса С по классификации Чайлда. Смертность, непосредственно
связанная с выполнением ТВПШ, составляет менее 2 %. В этих случаях летальные
исходы преимущественно вызваны нарушением сердечной деятельности во время
операции или возникновением кровотечения после прокола капсулы печени.
Тяжелые осложнения после проведения ТВПШ развиваются менее чем у 10 % пациентов;
это кровотечения в брюшную полость, которые могут самопроизвольно прекращаться,
инфаркт миокарда, преходящая почечная недостаточность, инфаркты печени
и отек легких.
35. Какие ранние и поздние
осложнения развиваются после произведения ТВПШ?
Острый тромбоз стента
хотя и редко, но возникает сразу или спустя короткое время после выполнения
ТВПШ. Лечение этого осложнения состоит в удалении или смещении тромба из
стента (так называемая шунтовая тромбэктомия). Поздний стеноз, или
окклюзия
шунта, обычно развивается в результате избыточной пролиферации тканей
внутри стента или в тех случаях, когда стент расположен не на всей протяженности
паренхимального хода шунта. Лечение заключается в выполнении ревизии шунта.
Проходимость шунта сохраняется у 70 % пациентов в течение первого года
и у 55 % — в течение второго года. Частота восстановления проходимости
шунта (после его ревизии) составляет более 90 %.
Наиболее серьезным из поздних
осложнений, развивающихся после произведения ТВПШ, является печеночная
энцефалопатия. Возникновение или усиление симптомов печеночной энцефалопатии
наблюдается у 20-30 % пациентов, перенесших ТВПШ. Обычно печеночную энцефалопатию
у таких пациентов лечат с помощью коррекции диеты и введения лактулозы.
К предрасполагающим факторам, увеличивающим риск развития печеночной энцефалопатии
у пациентов после произведения ТВПШ, относятся заболевания печени неалкогольной
этиологии, принадлежность к женскому полу, пожилой возраст, а также наличие
энцефалопатии в анамнезе.
36. Как можно подтвердить проходимость
шунта? Является ли этот метод обычным для таких пациентов?
Проходимость шунта устанавливается
с помощью цветного допплеровского ультразвукового сканирования. Основное
исследование проводится в первые 24 ч после выполнения ТВПШ. В случае отсутствия
каких-либо клинических проявлений нарушения проходимости шунта проводится
стандартное контрольное исследование через 3 мес и 6 мес после произведения
ТВПШ и далее исследования осуществляются с интервалом в 6 мес. Если же
у пациентов обнаруживаются какие-либо клинические проявления или при динамическом
ультразвуковом сканировании выявляются значительные изменения, проводятся
повторное ангиографическое исследование и соответствующее лечебное вмешательство
с целью восстановления нормальной проходимости шунта. |
